Kẽm – Wikipedia tiếng Việt
Kẽm là một nguyên tố kim loại chuyển tiếp, ký hiệu là Zn và có số nguyên tử là 30. Nó là nguyên tố đầu tiên trong nhóm 12 của bảng tuần hoàn các nguyên tố. Kẽm, trên một số phương diện, có tính chất hóa học giống với magiê, vì ion của chúng có bán kính giống nhau và có số oxy hóa duy nhất ở điều kiện bình thường là +2. Kẽm là nguyên tố phổ biến thứ 24 trong lớp vỏ Trái Đất và có 5 đồng vị bền. Quặng kẽm phổ biến nhất là quặng sphalerit, một loại kẽm sulfide. Những mỏ khai thác lớn nhất nằm ở Úc, Canada và Hoa Kỳ. Công nghệ sản xuất kẽm bao gồm tuyển nổi quặng, thiêu kết, và cuối cùng là chiết tách bằng dòng điện.
Đồng thau là một kim loại tổng hợp của đồng và kẽm đã khởi đầu được sử dụng muộn nhất từ thế kỷ X TCN tại Judea [ 2 ] và thế kỷ VII TCN tại Hy Lạp cổ đại. [ 3 ] Mãi cho đến thế kỷ XII thì kẽm nguyên chất mới được sản xuất quy mô lớn ở Ấn Độ, và đến cuối thế kỷ XVI thì người châu Âu mới biết đến kẽm sắt kẽm kim loại. Các mỏ ở Rajasthan được khai thác từ thế kỷ VI TCN. [ 4 ] Cho đến nay, dẫn chứng cổ xưa nhất về kẽm tinh khiết là từ Zawar ở Rajasthan vào khoảng chừng thế kỷ IX, người ta dùng chiêu thức chưng cất để tạo ra kẽm nguyên chất. [ 5 ] Các nhà giả kim thuật đốt kẽm trong không khí để tạo thành một chất mà họ gọi là ” len của nhà triết học ” hay ” tuyết trắng ” .
Nhà hóa học người Đức Andreas Sigismund Marggraf được công nhận đã tách được kẽm kim loại tinh khiết năm 1746. Luigi Galvani và Alessandro Volta đã phát hiện ra các đặc tính điện hóa học của kẽm vào năm 1800. Ứng dụng chính của kẽm là làm lớp phủ chống ăn mòn trên thép. Các ứng dụng khác như làm pin kẽm, và hợp kim như đồng thau. Nhiều hợp chất kẽm cũng được sử dụng phổ biến như kẽm cacbonat và kẽm gluconat (bổ sung dinh dưỡng), kẽm chloride (chất khử mùi), kẽm pyrithion (dầu gội đầu trị gàu), kẽm sulfide (sơn huỳnh quang), và kẽm methyl hay kẽm diethyl sử dụng trong hóa hữu cơ ở phòng thí nghiệm.
Bạn đang đọc: Kẽm – Wikipedia tiếng Việt
Kẽm là một chất khoáng vi lượng thiết yếu cho sinh vật và sức khỏe thể chất con người, đặc biệt quan trọng trong quy trình tăng trưởng của thai nhi và của trẻ sau khi sinh. [ 6 ] Thiếu kẽm tác động ảnh hưởng đến khoảng chừng 2 tỷ người ở những nước đang tăng trưởng và tương quan đến nguyên do 1 số ít bệnh. [ 7 ] Ở trẻ nhỏ, thiếu kẽm gây ra chứng chậm tăng trưởng, phát dục trễ, dễ nhiễm trùng và tiêu chảy, những yếu tố này gây thiệt mạng khoảng chừng 800.000 trẻ nhỏ trên toàn quốc tế mỗi năm. [ 6 ] Các enzym link với kẽm trong TT phản ứng có vai trò sinh hóa quan trọng như alcohol dehydrogenase ở người. [ 8 ] trái lại việc tiêu thụ quá mức kẽm hoàn toàn có thể gây ra một số ít chứng như hôn mê, bất động cơ và thiếu đồng .
Kẽm có màu trắng xanh, óng ánh và nghịch từ, [ 9 ] mặc dầu hầu hết kẽm phẩm cấp thương mại có màu xám xỉn. [ 10 ] Phân bố tinh thể của kẽm loãng hơn sắt và có cấu trúc tinh thể sáu phương [ 11 ] với một cấu trúc lục giác không đều, trong đó mỗi nguyên tử có sáu nguyên tử gần nhất ( cách 265,9 pm ) trong mặt phẳng riêng của chúng và sáu nguyên tử khác tại khoảng cách lớn hơn 290,6 pm. [ 12 ]Kẽm sắt kẽm kim loại cứng và giòn ở hầu hết cấp nhiệt độ nhưng trở nên dễ uốn từ 100 đến 150 °C. [ 9 ] [ 10 ] Trên 210 °C, sắt kẽm kim loại kẽm giòn trở lại và hoàn toàn có thể được tán nhỏ bằng lực. [ 13 ] Kẽm dẫn điện khá. [ 9 ] So với những sắt kẽm kim loại khác, kẽm có độ nóng chảy ( 419,5 °C, 787,1 F ) và điểm sôi ( 907 °C ) tương đối thấp. [ 14 ] Điểm sôi của nó là một trong số những điểm sôi thấp nhất của những sắt kẽm kim loại chuyển tiếp, chỉ cao hơn thủy ngân và cadmi. [ 14 ]
Một số hợp kim với kẽm như đồng thau, là hợp kim của kẽm và đồng. Các kim loại khác có thể tạo hợp kim 2 phần với kẽm như nhôm, antimon, bismuth, vàng, sắt, chì, thủy ngân, bạc, thiếc, magiê, coban, niken, teluride và natri.[15] Tuy cả kẽm và zirconi không có tính sắt từ, nhưng hợp kim của chúng ZrZn
2 lại thể hiện tính chất sắt từ dưới 35 K.[9]
Kẽm chiếm khoảng chừng 75 ppm ( 0,0075 % ) trong vỏ Trái Đất, là nguyên tố phổ cập thứ 24. Đất chứa 5-770 ppm kẽm với giá trị trung bình 64 ppm. Nước biển chỉ chứa 30 ppb kẽm và trong khí quyển chứa 0,1 – 4 µg / m³. [ 16 ] Sphalerit (ZnS), một loại quặng kẽm phổ biến.Nguyên tố này thường đi cùng với những nguyên tố sắt kẽm kim loại thường thì khác như đồng và chì ở dạng quặng. [ 17 ] Kẽm là một nguyên tố ưa tạo quặng ( chalcophile ), nghĩa là nguyên tố có ái lực thấp với oxy và thường link với lưu huỳnh để tạo ra những sulfide. Các nguyên tố ưa tạo quặng hình thành ở dạng lớp vỏ hóa cứng trong những điều kiện kèm theo khử của khí quyển Trái Đất. [ 18 ] Sphalerit là một dạng kẽm sulfide, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60-62 %. [ 17 ]Các loại quặng khác hoàn toàn có thể tịch thu được kẽm như smithsonit ( kẽm cacbonat ), hemimorphit ( kẽm silicat ), wurtzit ( loại kẽm sulfide khác ), và đôi lúc là hydrozincit ( kẽm cacbonat ). [ 19 ] Ngoại trừ wurtzit, tổng thể những khoáng trên được hình thành từ những quy trình phong hóa kẽm sulfide nguyên sinh. [ 18 ]Tổng tài nguyên kẽm trên quốc tế đã được xác nhận vào tầm 1,9 tỉ tấn. [ 20 ] Các mỏ kẽm lớn phân bổ ở Úc và Mỹ, và trữ lượng kẽm lớn nhất ở Iran, trong đó Iran có trữ lượng lớn nhất. [ 18 ] [ 21 ] [ 22 ] Với vận tốc tiêu thụ như lúc bấy giờ thì nguồn tài nguyên này ước tính sẽ hết sạch vào khoảng chừng năm từ 2027 đến 2055. [ 23 ] [ 24 ] Khoảng 346 triệu tấn kẽm đã được sản xuất trong suốt chiều dài lịch sử vẻ vang cho đến năm 2002, và theo một ước đạt cho thấy khoảng chừng 109 triệu tấn sống sót ở những dạng đang sử dụng. [ 25 ]
Sphalerit (ZnS), một loại quặng kẽm phổ biến.Nguyên tố này thường đi cùng với những nguyên tố sắt kẽm kim loại thường thì khác như đồng và chì ở dạng quặng. [ 17 ] Kẽm là một nguyên tố ưa tạo quặng ( chalcophile ), nghĩa là nguyên tố có ái lực thấp với oxy và thường link với lưu huỳnh để tạo ra những sulfide. Các nguyên tố ưa tạo quặng hình thành ở dạng lớp vỏ hóa cứng trong những điều kiện kèm theo khử của khí quyển Trái Đất. [ 18 ] Sphalerit là một dạng kẽm sulfide, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60-62 %. [ 17 ]Các loại quặng khác hoàn toàn có thể tịch thu được kẽm như smithsonit ( kẽm cacbonat ), hemimorphit ( kẽm silicat ), wurtzit ( loại kẽm sulfide khác ), và đôi lúc là hydrozincit ( kẽm cacbonat ). [ 19 ] Ngoại trừ wurtzit, tổng thể những khoáng trên được hình thành từ những quy trình phong hóa kẽm sulfide nguyên sinh. [ 18 ]Tổng tài nguyên kẽm trên quốc tế đã được xác nhận vào tầm 1,9 tỉ tấn. [ 20 ] Các mỏ kẽm lớn phân bổ ở Úc và Mỹ, và trữ lượng kẽm lớn nhất ở Iran, trong đó Iran có trữ lượng lớn nhất. [ 18 ] [ 21 ] [ 22 ] Với vận tốc tiêu thụ như lúc bấy giờ thì nguồn tài nguyên này ước tính sẽ hết sạch vào khoảng chừng năm từ 2027 đến 2055. [ 23 ] [ 24 ] Khoảng 346 triệu tấn kẽm đã được sản xuất trong suốt chiều dài lịch sử vẻ vang cho đến năm 2002, và theo một ước đạt cho thấy khoảng chừng 109 triệu tấn sống sót ở những dạng đang sử dụng. [ 25 ]
Kẽm trong tự nhiên là hỗn hợp của 5 đồng vị ổn định 64Zn, 66Zn, 67Zn, 68Zn và 70Zn, trong đó đồng vị 64 là phổ biến nhất (48,6% trong tự nhiên)[26] với chu kỳ bán rã 43×1018 năm,[27] do đó tính phóng xạ của nó có thể bỏ qua.[28] Tương tự, 70
30Zn
(0,6%), có chu kỳ bán rã 13×1016 năm thường không được xem là có tính phóng xạ. Các đồng vị khác là 66
Zn (28%), 67
Zn (4%) và 68
Zn (19%).
Một số đồng vị phóng xạ đã được nhận dạng. 65
Zn có chu kỳ bán rã 243,66 ngày, là đồng vị tồn tại lâu nhất, theo sau là 72
Zn có chu kỳ bán rã 46,5 giờ.[26] Kẽm có 10 đồng phân hạt nhân.69mZn có chu kỳ bán rã 13,76 giờ.[26] (tham số mũ m chỉ đồng vị giả ổn định). Các hạt nhân của đồng vị giả ổn định ở trong trạng thái kích thích và sẽ trở về trạng thái bình thường khi phát ra photon ở dạng tia gamma. 61
Zn có 3 trạng thái kích thích và 73
Zn có 2 trạng thái.[29] Mỗi đồng vị 65
Zn, 71
Zn, 77
Zn và 78
Zn chỉ có một trạng thái kích thích.[26]
Cơ chế phân rã phổ cập của đồng vị phóng xạ kẽm có số khối nhỏ hơn 66 là bắt electron, loại sản phẩm tạo thành là một đồng vị của đồng. [ 26 ]
- n
30Zn
+
e
⁻
→
n
29Cu
Cơ chế phân rã phổ cập của đồng vị phóng xạ kẽm có số khối lớn hơn 66 là phân rã beta ( β – ), mẫu sản phẩm tạo ra là đồng vị của gali. [ 26 ]
- n
30Zn
→
n
31Ga
+
e
⁻
+
ν
e
Mục lục bài viết
Tính chất hóa học và những hợp chất[sửa|sửa mã nguồn]
Khả năng phản ứng[sửa|sửa mã nguồn]
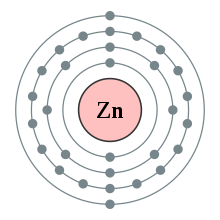 Phân bố electron trong nguyên tử kẽm
Phân bố electron trong nguyên tử kẽm
Kẽm có cấu hình electron là [Ar]3d104s2 và là nguyên tố thuộc nhóm 12 trong bảng tuần hoàn. Nó là kim loại có độ hoạt động trung bình và là chất oxy hóa mạnh.[30] Bề mặt của kim loại kẽm tinh khiết xỉn nhanh, thậm chí hình thành một lớp thụ động bảo vệ là Hydrozincit, Zn
5(OH)
6(CO3)
2, khi phản ứng với cacbon dioxide trong khí quyển.[31] Lớp này giúp chống lại quá trình phản ứng tiếp theo với nước và hydro.
Kẽm cháy trong không khí cho ngọn lửa màu xanh lục tạo ra khói kẽm oxide. [ 32 ] Kẽm thuận tiện phản ứng với những acid, kiềm và những phi kim khác. [ 33 ] Kẽm cực kỳ tinh khiết chỉ phản ứng một cách lừ đừ với những acid ở nhiệt độ phòng. [ 32 ] Các acid mạnh như acid clohydric hay acid sulfuric hoàn toàn có thể hòa tan lớp bảo vệ bên ngoài và sau đó kẽm phản ứng với nước giải phóng khí hydro. [ 32 ]
Tính chất hóa học của kẽm đặc trưng bởi trạng thái oxy hóa +2. Khi các hợp chất ở trạng thái này được hình thành thì các electron lớp s bị mất đi, và ion kẽm có cấu hình electron [Ar]3d10.[34] Quá trình này cho phép tạo 4 liên kết bằng cách tiếp nhận thêm 4 cặp electron theo quy tắc bộ tám. Dạng cấu tạo hóa học lập thể là tứ diện và các liên kết có thể được miêu tả như sự tạo thành của các orbitan lai ghép sp3 của ion kẽm.[35] Trong dung dịch, nó tạo phức phổ biến dạng bát diện là [Zn(H
2O)6]2+
.[36] Sự bay hơi của kẽm khi kết hợp với kẽm chloride ở nhiệt độ trên 285 °C chỉ ra sự hình thành Zn
2Cl
2, một hợp chất kẽm có trạng thái oxy hóa +1.[32] Không có hợp chất kẽm nào mà kẽm có trạng thái oxy hóa khác +1 hoặc +2.[37] Các tính toán chỉ ra rằng hợp chất kẽm có trạng thái oxy hóa +4 không thể tồn tại.[38]
Tính chất hóa học của kẽm tựa như đặc thù của những sắt kẽm kim loại chuyển tiếp nằm ở vị trí ở đầu cuối của hàng tiên phong như niken và đồng, mặc dầu nó có lớp d được lấp đầy electron, do đó những hợp chất của nó là nghịch từ và phần đông không màu. [ 39 ] Bán kính ion của kẽm và magnesi gần như bằng nhau. Do đó 1 số ít muối của chúng có cùng cấu trúc tinh thể [ 40 ] và trong một số ít trường hợp khi nửa đường kính ion là yếu tố quyết định hành động thì đặc thù hóa học của kẽm và magnesi là rất giống nhau. [ 32 ] còn nếu không thì chúng có rất ít nét tương đương. Kẽm có khuynh hướng tạo thành những link cộng hóa trị với Lever cao hơn và nó tạo thành những phức bền hơn với những chất cho N – và S. [ 39 ] Các phức của kẽm hầu hết là có phối vị 4 hoặc 6, tuy nhiên phức phối vị 5 cũng có. [ 32 ] Kẽm acetat
Kẽm acetat Kẽm chloride
Kẽm chloride
Hợp chất hai nguyên tố của kẽm được tạo ra với hầu hết á kim và tất cả các phi kim trừ khí hiếm. ZnO là chất bột màu trắng và hầu như không tan trong các dung dịch trung tính, vì là một chất trung tính nó tan trong cả dung dịch acid và base.[32] Các chalcogenua khác (ZnS, ZnSe, và ZnTe) có nhiều ứng dụng khác nhau trong điện tử và quang học.[41] Pnictogenua (Zn
3N
2, Zn
3P
2, Zn
3As
2 và Zn
3Sb
2),[42][43] peroxide (ZnO
2), hydride (ZnH
2), và carbide (ZnC
2) cũng tồn tại.[44] Trong số 4 halide, ZnF
2 có đặc trưng ion nhiều nhất, trong khi các hợp chất halide khác (ZnCl
2, ZnBr
2, và ZnI
2) có điểm nóng chảy tương đối thấp và được xem là có nhiều đặc trưng cộng hóa trị hơn.[45]
Trong các dung dịch base yếu chứa các ion Zn2+
, hydroxide Zn(OH)
2 tạo thành ở dạng kết tủa màu trắng. Trong các dung dịch kiềm mạnh hơn, hydroxide này bị hòa tan và tạo zincat ([Zn(OH)4]2−
).[32] Nitrat Zn(NO3)
2, clorat Zn(ClO3)
2, sulfat ZnSO
4, phosphat Zn
3(PO4)
2, molybdat ZnMoO
4, cyanide Zn(CN)
2, asenit Zn(AsO2)
2, asenat Zn3(AsO4)2.8H2O và cromat ZnCrO
4 (một trong những hợp chất kẽm có màu) là một vài ví dụ về các hợp chất vô cơ phổ biến của kẽm.[46][47] Một trong những ví dụ đơn giản nhất về hợp chất hữu cơ của kẽm là acetat (Zn(O
2CCH3)
2).
Các hợp chất hữu cơ của kẽm là dạng hợp chất mà trong đó có các liên kết cộng hóa trị kẽm-cacbon. Diethyl kẽm ((C
2H5)
2Zn) là một thuốc thử trong hóa tổng hợp. Nó được công bố đầu tiên năm 1848 từ phản ứng của kẽm và ethyl iodide, và là hợp chất đầu tiên chứa liên kết sigma kim loại-cacbon.[48] Decamethyldizincocen chứa một liên kết mạnh kẽm-kẽm ở nhiệt độ phòng.[49]
Thời kỳ cổ đại[sửa|sửa mã nguồn]
Các vật mẫu riêng không liên quan gì đến nhau sử dụng kẽm không nguyên chất trong thời kỳ cổ đại đã được phát hiện. Các loại quặng kẽm đã được sử dụng để làm kim loại tổng hợp đồng-kẽm là đồng thau vài thế kỷ trước khi phát hiện ra kẽm ở dạng nguyên tố riêng không liên quan gì đến nhau. Đồng thau Palestin có từ thế kỷ XIV TCN đến thế kỷ X TCN chứa 23 % kẽm. [ 2 ]Hiểu biết về cách sản xuất đồng thau phổ cập ở Hy Lạp cổ đại từ thế kỷ VII TCN, nhưng chỉ có vài mẫu được triển khai. [ 3 ] Các đồ trang trí bằng kim loại tổng hợp chứa 80-90 % kẽm với chì, sắt, antimon và những sắt kẽm kim loại khác cấu thành phần còn lại, đã được phát hiện có độ tuổi là 2.500 năm. [ 17 ] Một bức tượng nhỏ hoàn toàn có thể từ thời tiền sử chứa 87,5 % kẽm được tìm thấy ở di chỉ khảo cổ Dacia ở Transilvania ( Romania thời nay ). [ 50 ]Các viên thuốc cổ nhất được làm từ kẽm cacbonat hydrozincit và smithsonit. Các viên thuốc này được dùng để chữa đau mắt và được tìm thấy trên tàu La Mã Relitto del Pozzino bị đắm năm 140 TCN. [ 51 ] [ 52 ]Việc sản xuất đồ đồng thau đã được người La Mã biết đến vào khoảng chừng năm 30 TCN, [ 53 ] họ sử dụng công nghệ tiên tiến nấu calamin ( kẽm silicat hay cacbonat ) với than củi và đồng trong những nồi nấu. [ 53 ] Lượng oxide kẽm giảm xuống và kẽm tự do bị đồng giữ lại, tạo ra kim loại tổng hợp là đồng thau. Đồng thau sau đó được đúc hay rèn thành những chủng loại vật phẩm và vũ khí. [ 54 ] Một số tiền xu từ người La Mã trong thời đại Công giáo được làm từ loại vật tư hoàn toàn có thể là đồng thau calamin. [ 55 ] Ở phương Tây, kẽm lẫn tạp chất từ thời cổ đại sống sót ở dạng tàn dư trong lò nung chảy, nhưng nó thường bị bỏ đi vì người ta nghĩ nó không có giá trị. [ 56 ]
Bảng kẽm Bern là một tấm thẻ tạ ơn có niên đại tới thời kỳ Gaul La Mã được làm bằng hợp kim bao gồm phần lớn là kẽm.[57] Một số văn bản cổ đại dường như cũng đề cập đến kẽm. Sử gia Hy Lạp Strabo, trong một đoạn văn lấy từ nhà văn trước đó trong thế kỷ IV TCN, đề cập tới “những giọt bạc giả”, được trộn lẫn với đồng để làm đồng thau. Điều này có thể đề cập đến một lượng nhỏ kẽm là phụ phẩm của quá trình nung chảy quặng sulfide.[58] Charaka Samhita, cho là đã được viết vào 500 TCN hay trước đó nữa, đề cập đến một kim loại mà khi bị oxy hóa, tạo ra pushpanjan, sản phẩm được cho là kẽm oxide.[59]
Các mỏ kẽm ở Zawar, gần Udaipur, Ấn Độ đã từng hoạt động giải trí từ thời đại Maurya vào cuối thiên niên kỷ 1 TCN. Việc nấu chảy và phân lập kẽm nguyên chất đã được những người Ấn Độ thực thi sớm nhất vào thế kỷ XII. [ 60 ] [ 61 ] Một ước tính cho thấy rằng khu vực này đã sản xuất ra khoảng chừng vài triệu tấn kẽm sắt kẽm kim loại và kẽm oxide từ thế kỷ XII đến thế kỷ XVI. [ 19 ] Một ước tính khác đưa ra số lượng sản lượng là 60.000 tấn kẽm sắt kẽm kim loại trong tiến trình này. [ 60 ] Rasaratna Samuccaya, được viết vào khoảng chừng thế kỷ XIV, đề cập đến hai loại quặng chứa kẽm ; một loại được sử dụng để tách sắt kẽm kim loại và loại khác được dùng cho y học. [ 61 ]
Các điều tra và nghiên cứu trước đây và tên gọi[sửa|sửa mã nguồn]
Kẽm đã từng được công nhận là một kim loại có tên gọi ban đầu là Fasada theo như y học Lexicon được cho là của vua Hindu Madanapala và được viết vào khoảng năm 1374.[62] Nung chảy và tách kẽm nguyên chất bằng cách khử calamin với len và các chất hữu cơ khác đã được tiến hành vào thế kỷ XIII ở Ấn Độ.[9][63] Người Trung Quốc cho tới thế kỷ XVII vẫn chưa học được kỹ thuật này.[63]
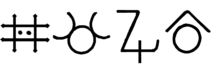 Các ký hiệu giả kim thuật tương trưng cho kẽm
Các ký hiệu giả kim thuật tương trưng cho kẽm
Các nhà giả kim thuật đã đốt kẽm kim loại trong không khí và thu được kẽm oxide trong một lò ngưng tụ. Một số nhà giả kim thuật gọi loại kẽm oxide này là lana philosophica, tiếng Latin có nghĩa là “len của các nhà triết học”, do nó được thu hồi từ búi len trong khi những người khác nghĩ nó giống như tuyết trắng và đặt tên nó là nix album.[64]
Tên gọi của kẽm ở phương Tây có thể được ghi nhận đầu tiên bởi nhà giả kim Đức gốc Thụy Sĩ Paracelsus, ông đã gọi tên kim loại này là “zincum” hay “zinken” trong quyển sách của mình là Liber Mineralium II được viết vào thế kỷ XVI.[63][65] Từ này có thể bắt nguồn từ tiếng Đức zinke, và có thể có nghĩa là “giống như răng, nhọn hoặc lởm chởm” (các tinh thể kẽm kim loại có hình dạng giống như những chiếc kim).[66] Zink cũng có thể ám chỉ “giống như tin (thiếc)” do mối quan hệ của nó (trong tiếng Đức zinn nghĩa là thiếc).[67] Một khả năng khác có thể là từ đó xuất phát từ tiếng Ba Tư سنگ seng nghĩa là đá.[68] Kim loại cũng có thể gọi là thiếc Ấn Độ, tutanego, calamin, và spinter.[17]
Nhà luyện kim người Đức Andreas Libavius đã nhận được một lượng vật liệu mà ông gọi là “calay” của Malabar từ một tàu chở hàng bắt được ở Bồ Đào Nha năm 1596.[69] Libavius đã miêu tả các thuộc tính của mẫu vật có thể là kẽm này. Kẽm thường được nhập khẩu đến châu Âu từ các nước phương Đông trong thế kỷ XVII và đầu thế kỷ XVIII,[63] nhưng rất đắt giá vào lúc đó.[note 1]
 Andreas Sigismund Marggraf được xem là người đầu tiên cô lập được kim loại kẽm nguyên chất
Andreas Sigismund Marggraf được xem là người đầu tiên cô lập được kim loại kẽm nguyên chất
Việc tách kẽm kim loại đã được thực hiện ở Ấn Độ vào năm 1300,[70][71][72] sớm hơn nhiều so với phương Tây. Trước khi nó được thực hiện ở châu Âu, nó đã được nhập khẩu vào Ấn Độ khoảng năm 1600.[73] Việc tách kim loại kẽm ở phương Tây có thể đã đạt được những thành tựu một cách độc lập từ một số người. Universal Dictionary (Từ điển tổng hợp) của Postlewayt, một nguồn cung cấp thông tin kỹ thuật ở châu Âu, đã không đề cập đến kẽm trước năm 1751, nhưng nguyên tố này đã được nghiên cứu từ trước đó.[61][74]
Nhà luyện kim người Flanders là P.M. de Respour đã công bố rằng ông đã tách được kẽm sắt kẽm kim loại từ kẽm oxide năm 1668. [ 19 ] Sau đó, Étienne François Geoffroy đã miêu tả phương pháp mà kẽm oxide cô đặc lại thành những tinh thể màu vàng trên những thanh sắt được đặt bên trên những quặng kẽm đang nóng chảy. [ 19 ] Ở Anh, John Lane được cho là đã triển khai những thí nghiệm để nung chảy kẽm, hoàn toàn có thể ở Landore, trước khi ông phá sản năm 1726. [ 75 ]Năm 1738, William Champion được cấp văn bằng bản quyền trí tuệ ở Đại Anh cho quy trình tách kẽm từ calamin trong một lò luyện theo kiểu bình cổ cong thẳng đứng. [ 76 ] Công nghệ của ông một phần nào đó giống với cách được sử dụng trong những mỏ kẽm ở Zawar thuộc Rajasthan nhưng không có dẫn chứng nào cho thấy ông đã đến vùng phương đông. [ 73 ] Phương pháp của Champion được sử dụng suốt năm 1851. [ 63 ]Nhà hóa học người Đức Andreas Marggraf được xem là có công trong việc phát hiện ra kẽm sắt kẽm kim loại nguyên chất mặc dầu nhà hóa học Thụy Điển là Anton von Swab đã chưng cất kẽm từ calamin 4 năm trước đó. [ 63 ] Trong thí nghiệm năm 1746 của ông, Marggraf đã nung hỗm hợp calamin và than củi trong một buồng kín không có đồng để lấy sắt kẽm kim loại. [ 56 ] Quy trình này được ứng dụng ở quy mô thương mại từ năm 1752. [ 77 ]
Các khu công trình sau này[sửa|sửa mã nguồn]
Một người đồng đội của William Champion là John đã nhận được văn bằng bản quyền trí tuệ năm 1758 về việc nung kẽm sulfide thành một oxide hoàn toàn có thể sử dụng trong quá trình chưng cất bằng lò cổ cong. [ 17 ] Trước đó chỉ có calamin mới hoàn toàn có thể được sử dụng để sản xuất kẽm. Năm 1798, Johann Christian Ruberg nâng cấp cải tiến quy trình nung chảy bằng cách thiết kế xây dựng một lò nung chưng cất nằm ngang. [ 78 ] Jean-Jacques Daniel Dony đã thiết kế xây dựng một lò nung chảy nằm ngang theo một kiểu khác ở Bỉ, lò nung này hoàn toàn có thể giải quyết và xử lý nhiều kẽm hơn. [ 63 ] Bác sĩ người Ý Luigi Galvani mày mò ra vào năm 1780 rằng việc liên kết tủy sống của một con ếch vừa mới mổ với một sợi sắt có gắn một cái mốc bằng đồng thau sẽ làm cho chân ếch co giật. [ 79 ] Ông ta đã nghĩ không đúng chuẩn rằng ông đã phát hiện một năng lực của nơ ron và cơ để tạo ra điện và gọi đó là hiệu ứng ” điện động vật “. [ 80 ] Tế bào mạ và quy trình mạ đều được đặt tên theo Luigi Galvani và những phát hiện này đã mở đường cho pin điện, mạ điện và chống ăn mòn điện. [ 80 ]Bạn của Galvani là Alessandro Volta đã liên tục điều tra và nghiên cứu hiệu ứng này và đã ý tưởng ra pin Volta năm 1800. [ 79 ] Đơn vị cơ bản của pin Volta là những tế bào mạ điện được đơn giản hóa, chúng được làm từ một tấm đồng và một tấm kẽm được kết nối với nhau ở bên ngoài và ngăn cách bởi một lớp điện ly. Các tấm này được xếp thành một chuỗi để tạo ra tế bào Volta, những tế bào này tạo ra điện bằng những dòng electron chạy từ tấm kẽm qua tấm đồng và được cho phép kẽm ăn mòn. [ 79 ]Tính chất không từ tính của kẽm và không màu của nó trong dung dịch đã làm trì hoãn việc phát hiện ra những đặc thù quan trọng của chíng trong sinh hóa và dinh dưỡng. [ 81 ] Nhưng điều đó đã biến hóa vào năm 1940 khi mà cacbonic anhydrase, một loại enzym đẩy cacbon dioxide ra khỏi máu, đã cho thấy kẽm có vai trò quan trọng trong nó. [ 81 ] Enzym tiêu hóa carboxypeptidase là enzym chứa kẽm thứ hai được phát hiện năm 1955. [ 81 ]
Khai thác mỏ và giải quyết và xử lý[sửa|sửa mã nguồn]
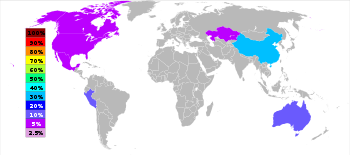 [82]Tỉ lệ sản xuất kẽm năm 2006 theo vương quốc
[82]Tỉ lệ sản xuất kẽm năm 2006 theo vương quốc
Kẽm là kim loại được sử dụng phổ biến thứ 4 sau sắt, nhôm và đồng với sản lượng hàng năm khoảng 13 triệu tấn.[20] Nhà sản xuất kẽm lớn nhất thế giới là Nyrstar, công ty sáp nhập từ OZ Minerals của Úc và Umicore của Bỉ.[83] Khoảng 70% lượng kẽm trên thế giới có nguồn gốc từ khai thác mỏ, lượng còn lại từ hoạt động tái sử dụng.[84] Kẽm tinh khiết cấp thương mại có tên gọi trong giao dịch tiếng Anh là Special High Grade (SHG) có độ tinh khiết 99,995%.[85]
Trên toàn thế giới, 95 % kẽm được khai thác từ những mỏ quặng sulfide, trong đó ZnS luôn lẫn với đồng, chì và sắt sulfide. [ 86 ] Có nhiều mỏ kẽm trên khắp quốc tế nhưng hầu hết ở Trung Quốc, Úc và Peru. Trung Quốc sản xuất 29 % lượng kẽm toàn thế giới năm 2010. [ 20 ]
Kẽm kim loại được sản xuất bằng luyện kim khai khoáng.[87] Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng.[87] Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO
2 (5%).[87]
Công đoạn thiêu kết sẽ chuyển kẽm sulfide thành kẽm oxide : [ 86 ]
- 2 ZnS + 3
O
2
→ 2 ZnO + 2
SO
2
Lưu huỳnh dioxide sinh ra sẽ được tịch thu để sản xuất acid sulfuric. Nếu những mỏ có loại tài nguyên khác là kẽm cacbonat, kẽm silicat hoặc kẽm spinel như ở mỏ Skorpion, Namibia thì không sử dụng quy trình thiêu kết này. [ 88 ]
Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện chiết (electrowinning). Quá trình nhiệt luyện khử kẽm oxide với cacbon hoặc cacbon mônoxide ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi.[89] Hơi kẽm được thu hồi trong bình ngưng.[86] Quá trình được biểu diễn theo các phương trình dưới đây:[86]
- 2 ZnO + C → 2 Zn +
CO
2
- 2 ZnO + 2 CO → 2 Zn + 2
CO
2
Quá trình điện chiết tách kẽm từ quặng tinh bằng acid sulfuric : [ 90 ]
- ZnO +
H
2
SO
4
→
ZnSO
4
+
H
2
Xem thêm: Lời bài hát Ta Cứ Đi Cùng Nhau
O
Sau đó, người ta dùng giải pháp điện phân để sản xuất kẽm sắt kẽm kim loại. [ 86 ]
- 2
ZnSO
4
+ 2
H
2
O
→ 2 Zn + 2
H
2
SO
4
+
O
2
Acid sulfuric sinh ra được tái sử dụng trong bước trước đó .Kẽm xuất hiện ở dạng bụi trong lò hồ quang điện do sử dụng nguyên vật liệu mạ kẽm được thu hồ bởi nhiều quy trình, đa phần là quy trình Waelz ( 90 % đến năm năm trước ). [ 91 ]
Tác động thiên nhiên và môi trường[sửa|sửa mã nguồn]
Quá trình sản xuất từ quặng kẽm sulfide thải ra một lượng lớn lưu huỳnh dioxide và hơi cadmi. Xỉ nóng chảy và những chất cặn khác trong quy trình sản xuất cũng chứa một lượng sắt kẽm kim loại nặng đáng kể. Có khoảng chừng 1,1 triệu tấn kẽm sắt kẽm kim loại và 130 ngàn tấn chì đã được khai thác và nung chảy ở những thị xã La Calamine và Plombières của Bỉ trong khoảng chừng thời hạn từ năm 1806 tới năm 1882. [ 92 ] Bãi thải của mỏ trước đây rò rỉ kẽm và cadmi, và những trầm tích trong sông Geul chứa một lượng sắt kẽm kim loại nặng đáng kể. [ 92 ] Từ khoảng cách đây 2000 năm, lượng phát thải kẽm từ những nguồn khai thác mỏ và nung chảy đã thải ra tổng số 10 ngàn tấn mỗi năm. Đến năm 1850, lượng phát thải tăng lên gấp 10 lần, phát thải kẽm ở mức đỉnh vào khoảng chừng 3,4 triệu tấn mỗi năm trong thập niên 1980 và giảm xuống 2,7 triệu tấn vào thập niên 1990, mặc dầu theo một nghiên cứu và điều tra năm 2005 về tầng đối lưu Bắc Cực chỉ ra rằng nồng độ kẽm không giảm. Các phát thải tự tạo và tự nhiên xảy ra với tỷ suất 20 trên 1. [ 93 ]Hàm lượng kẽm trong những con sông chảy qua những khu công nghiệp và khu vực khai thác mỏ vào lúc 20 ppm. [ 94 ] Công tác giải quyết và xử lý nước thải hiệu suất cao đã làm giảm đáng kể hàm lượng này ; ví dụ như công tác làm việc giải quyết và xử lý nước thải dọc theo sông Rhine đã làm giảm lượng kẽm xuống còn 50 ppb. [ 94 ] Nồng độ kẽm ở mức 2 ppm ảnh hưởng tác động xấu đến hàm lượng oxy trong máu cá. [ 95 ] [96] các công trình liên quan đến kẽm ở [97]Lịch sử để lại hàm lượng sắt kẽm kim loại nặng cao trong Sông Derwent những khu công trình tương quan đến kẽm ở Lutana là nơi xuất khẩu kẽm lớn nhất ở Tasmania, mang lại 2,5 % GDP của bang này, với sản lượng hơn 250 ngàn tấn kẽm mỗi năm .Đất ô nhiễm kẽm từ hoạt động giải trí khai thác quặng chứa kẽm, tuyển, hoặc nơi sử dụng bùn chứa kẽm để làm phân, hoàn toàn có thể chứa hàm lượng kẽm ở mức vài gam kẽm / kg đất khô. Hàm lượng kẽm trong đất cao hơn 500 ppm ảnh hưởng tác động tới năng lực hấp thu những sắt kẽm kim loại thiết yếu khác của thực vật, như sắt và mangan. Kẽm ở mức 2 nghìn ppm đến 180.000 ppm ( 18 % ) đã được ghi nhận trong một số ít mẫu đất. [ 94 ]
[96] các công trình liên quan đến kẽm ở [97]Lịch sử để lại hàm lượng sắt kẽm kim loại nặng cao trong Sông Derwent những khu công trình tương quan đến kẽm ở Lutana là nơi xuất khẩu kẽm lớn nhất ở Tasmania, mang lại 2,5 % GDP của bang này, với sản lượng hơn 250 ngàn tấn kẽm mỗi năm .Đất ô nhiễm kẽm từ hoạt động giải trí khai thác quặng chứa kẽm, tuyển, hoặc nơi sử dụng bùn chứa kẽm để làm phân, hoàn toàn có thể chứa hàm lượng kẽm ở mức vài gam kẽm / kg đất khô. Hàm lượng kẽm trong đất cao hơn 500 ppm ảnh hưởng tác động tới năng lực hấp thu những sắt kẽm kim loại thiết yếu khác của thực vật, như sắt và mangan. Kẽm ở mức 2 nghìn ppm đến 180.000 ppm ( 18 % ) đã được ghi nhận trong một số ít mẫu đất. [ 94 ] Bề mặt tinh thể được mạKẽm là sắt kẽm kim loại được sử dụng thông dụng hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm. Các ứng dụng chính của kẽm ( số liệu là ở Hoa Kỳ ) [ 98 ]
Bề mặt tinh thể được mạKẽm là sắt kẽm kim loại được sử dụng thông dụng hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm. Các ứng dụng chính của kẽm ( số liệu là ở Hoa Kỳ ) [ 98 ]
- Mạ kẽm (55%)
- Hợp kim (21%)
- Đồng thau và đồng điếu (16%)
- Khác (8%)
Chống ăn mòn và pin[sửa|sửa mã nguồn]
Kim loại kẽm hầu hết được dùng làm chất chống ăn mòn, [ 99 ] ở dạng mạ. Năm 2009 ở Hoa Kỳ, 55 % tương tự 893 nghìn tấn kẽm sắt kẽm kim loại được dùng để mạ. [ 98 ]
Kẽm phản ứng mạnh hơn sắt hoặc thép và do đó nó sẽ dễ bị oxy hóa cho đến khi nó bị ăn mòn hoàn toàn.[100] Một lớp tráng bề mặt ở dạng bằng oxide và cacbonat (Zn
5(OH)
6(CO
3)
2) là một chất ăn mòn từ kẽm.[101] Lớp bảo vệ này tồn tại kéo dài ngay cả sau khi lớp kẽm bị trầy xước, nhưng nó sẽ giảm theo thời gian khi lớp ăn mòn kẽm bị tróc đi.[101] Kẽm được phủ lên theo phương pháp hóa điện bằng cách phun hoặc mạ nhúng nóng.[16] Mạ kẽm được sử dụng trên rào kẽm gai, rào bảo vệ, cầu treo, mái kim loại, thiết bị trao đổi nhiệt, và các bộ phận của ô tô.[16]
Độ hoạt động giải trí tương đối của kẽm và năng lực của nó bị oxy hóa làm nó có hiệu suất cao trong việc hi sinh anot để bảo vệ ăn mòn catot. Ví dụ, bảo vệ catot của một đường ống được chôn dưới đất hoàn toàn có thể đạt hiệu suất cao bằng cách liên kết những anot được làm bằng kẽm với những ống này. [ 101 ] Kẽm có vai trò như một anot ( âm ) bằng những ăn mòn một cách lừ đừ khi dòng điện chạy qua nó đến ống dẫn bằng thép. [ 101 ] [ note 2 ] Kẽm cũng được sử dụng trong việc bảo vệ những sắt kẽm kim loại được dùng làm catot khi chúng bị ăn mòn khi tiếp xúc với nước biển. [ 102 ] Một đĩa kẽm được gắn với một bánh lái bằng sắt của tàu sẽ làm chậm vận tốc ăn mòn so với không gắn tấm kẽm này. [ 100 ] Các ứng dụng tương tự như như gắn kẽm vào chân vịt hoặc lớp sắt kẽm kim loại bảo vệ lườn tàu .
Với một thế điện cực chuẩn ( SEP ) 0,76 vôn, kẽm được sử dụng làm vật tư anot cho pin. Bột kẽm được sử dụng theo cách này trong những loại pin kiềm và những tấm kẽm sắt kẽm kim loại tạo thành vỏ bọc và cũng là anot trong pin kẽm-cacbon. [ 103 ] [ 104 ] Kẽm được sử dụng làm anot hoặc nguyên vật liệu cho tế bào nhiêu liệu kẽm / pin kẽm-không khí. [ 105 ] [ 106 ] [ 107 ] Pin dòng oxy hóa khử kẽm-xêri cũng dựa trên 50% tế bào âm kẽm. [ 108 ]
Hợp kim của kẽm được sử dụng thoáng rộng nhất là đồng thau, gồm có đồng và khoảng chừng từ 3 % đến 45 % kẽm tùy theo loại đồng thau. [ 101 ] Đồng thau nhìn chung giòn và cứng hơn đồng và có năng lực chống ăn mòn rất cao. [ 101 ] Các đặc thù này giúp nó được sử dụng nhiều trong những thiết bị tiếp thị quảng cáo, phần cứng máy tính, dụng cụ âm nhạc, và những van nước. [ 101 ] Vi cấu trúc đồng thau đúc phóng đại 400 lầnCác ứng dụng thoáng rộng khác của kim loại tổng hợp chứa kẽm gồm có niken bạc, máy đánh chữ bằng sắt kẽm kim loại, hàn nhôm và mềm, và đồng điếu thương mại. [ 9 ] Kẽm cũng được sử dụng trong những bộ phận đường ống văn minh như là một loại sản phẩm thay thế sửa chữa những đường ống trước đây sử dụng kim loại tổng hợp chì / thiếc. [ 109 ] Các kim loại tổng hợp chiếm 85-88 % kẽm, 4-10 % đồng, và 2-8 % nhôm được sử dụng hạn chế trong một số ít trường hợp của những bệ nâng đỡ máy. Kẽm là một sắt kẽm kim loại bắt đầu được sử dụng trong việc sản xuất những đồng xu tiền 1 cent của Hoa Kỳ từ năm 1982. [ 110 ] Lõi kẽm được áo một lớp đồng mỏng mảnh để tạo độ đẹp mắt của đồng xu tiền bằng đồng. Năm 1994, 33.200 tấn ( 36.600 tấn Mỹ ) kẽm được sử dụng để sản xuất 13,6 triệu đồng xu ở Hoa Kỳ. [ 111 ]Các kim loại tổng hợp đa phần là kẽm với một lượng nhỏ đồng, nhôm, và magnesi có ích trong việc đúc áp lực đè nén cũng như đúc quay, đặc biệt quan trọng trong những ngành công nghiệp tự động hóa, điện tử, và phần cứng. [ 9 ] Các kim loại tổng hợp này được chào bán trên thị trường với tên gọi là Zamak. [ 112 ] Ví dụ về kim loại tổng hợp kẽm nhôm, nó có điểm nóng chảy thấp và độ nhớt thấp nên hoàn toàn có thể sản xuất ra những vật có hình dạng nhỏ và phức tạp. Nhiệt độ gia công thấp làm cho những loại sản phẩm đúc nguội nhanh và do đó có thế lắp ráp chúng một cách nhanh gọn. [ 9 ] [ 113 ] Một kim loại tổng hợp khác được chào bán trên thị trường với tên gọi là Prestal chứa 78 % kẽm và 22 % nhôm và được cho là có độ cứng gần bằng thép nhưng lại dẻo như nhựa. [ 9 ] [ 114 ] Tính chất siêu nhựa này của kim loại tổng hợp được cho phép đúc chúng thuận tiện trong những khuôn bằng sứ và xi-măng. [ 9 ]Các kim loại tổng hợp tựa như khi có thêm vào một lượng nhỏ chì hoàn toàn có thể cán nguội thành những tấm. Hợp kim có 96 % kẽm và 4 % nhôm được sử dụng để làm khuôn dập cho những ứng dụng có vận tốc sản xuất thấp mà khuôn dập bằng sắt kẽm kim loại đen hoàn toàn có thể quá đắt. [ 115 ] Trong việc xây những mặt phẳng ngoài, mái nhà hoặc những ứng dụng khác, kẽm được sử dụng ở dạng tấm sắt kẽm kim loại và hoàn toàn có thể dùng để cán, cuộn hoặc uốn người ta sử dụng những kim loại tổng hợp của kẽm với titan và đồng. [ 116 ]Là một vật tư dễ gia công, không đắt mà nặng, kẽm được sử dụng để sửa chữa thay thế cho chì. Do ngộ độc chì ngày càng nhiều nên kẽm được dùng làm vật nặng trong nhiều ứng dụng khác nhau như câu cá [ 117 ] đến cân đối lốp và bánh đà ( bánh trớn ). [ 118 ]Kẽm cadmi tellurua ( CZT ) là một kim loại tổng hợp bán dẫn hoàn toàn có thể được chia thành một chuỗi những thiết bị cảm ứng nhỏ. [ 119 ] Các thiết bị này tương tự như như mạch tích hợp và hoàn toàn có thể phát hiện nguồn nguồn năng lượng của những photon tia gama. [ 119 ] Khi được đặt sau một mặt nạ hấp thụ, thiết bị cảm ứng CZT cũng hoàn toàn có thể được sử dụng để xác lập hướng của những tia gamma. [ 119 ]
Vi cấu trúc đồng thau đúc phóng đại 400 lầnCác ứng dụng thoáng rộng khác của kim loại tổng hợp chứa kẽm gồm có niken bạc, máy đánh chữ bằng sắt kẽm kim loại, hàn nhôm và mềm, và đồng điếu thương mại. [ 9 ] Kẽm cũng được sử dụng trong những bộ phận đường ống văn minh như là một loại sản phẩm thay thế sửa chữa những đường ống trước đây sử dụng kim loại tổng hợp chì / thiếc. [ 109 ] Các kim loại tổng hợp chiếm 85-88 % kẽm, 4-10 % đồng, và 2-8 % nhôm được sử dụng hạn chế trong một số ít trường hợp của những bệ nâng đỡ máy. Kẽm là một sắt kẽm kim loại bắt đầu được sử dụng trong việc sản xuất những đồng xu tiền 1 cent của Hoa Kỳ từ năm 1982. [ 110 ] Lõi kẽm được áo một lớp đồng mỏng mảnh để tạo độ đẹp mắt của đồng xu tiền bằng đồng. Năm 1994, 33.200 tấn ( 36.600 tấn Mỹ ) kẽm được sử dụng để sản xuất 13,6 triệu đồng xu ở Hoa Kỳ. [ 111 ]Các kim loại tổng hợp đa phần là kẽm với một lượng nhỏ đồng, nhôm, và magnesi có ích trong việc đúc áp lực đè nén cũng như đúc quay, đặc biệt quan trọng trong những ngành công nghiệp tự động hóa, điện tử, và phần cứng. [ 9 ] Các kim loại tổng hợp này được chào bán trên thị trường với tên gọi là Zamak. [ 112 ] Ví dụ về kim loại tổng hợp kẽm nhôm, nó có điểm nóng chảy thấp và độ nhớt thấp nên hoàn toàn có thể sản xuất ra những vật có hình dạng nhỏ và phức tạp. Nhiệt độ gia công thấp làm cho những loại sản phẩm đúc nguội nhanh và do đó có thế lắp ráp chúng một cách nhanh gọn. [ 9 ] [ 113 ] Một kim loại tổng hợp khác được chào bán trên thị trường với tên gọi là Prestal chứa 78 % kẽm và 22 % nhôm và được cho là có độ cứng gần bằng thép nhưng lại dẻo như nhựa. [ 9 ] [ 114 ] Tính chất siêu nhựa này của kim loại tổng hợp được cho phép đúc chúng thuận tiện trong những khuôn bằng sứ và xi-măng. [ 9 ]Các kim loại tổng hợp tựa như khi có thêm vào một lượng nhỏ chì hoàn toàn có thể cán nguội thành những tấm. Hợp kim có 96 % kẽm và 4 % nhôm được sử dụng để làm khuôn dập cho những ứng dụng có vận tốc sản xuất thấp mà khuôn dập bằng sắt kẽm kim loại đen hoàn toàn có thể quá đắt. [ 115 ] Trong việc xây những mặt phẳng ngoài, mái nhà hoặc những ứng dụng khác, kẽm được sử dụng ở dạng tấm sắt kẽm kim loại và hoàn toàn có thể dùng để cán, cuộn hoặc uốn người ta sử dụng những kim loại tổng hợp của kẽm với titan và đồng. [ 116 ]Là một vật tư dễ gia công, không đắt mà nặng, kẽm được sử dụng để sửa chữa thay thế cho chì. Do ngộ độc chì ngày càng nhiều nên kẽm được dùng làm vật nặng trong nhiều ứng dụng khác nhau như câu cá [ 117 ] đến cân đối lốp và bánh đà ( bánh trớn ). [ 118 ]Kẽm cadmi tellurua ( CZT ) là một kim loại tổng hợp bán dẫn hoàn toàn có thể được chia thành một chuỗi những thiết bị cảm ứng nhỏ. [ 119 ] Các thiết bị này tương tự như như mạch tích hợp và hoàn toàn có thể phát hiện nguồn nguồn năng lượng của những photon tia gama. [ 119 ] Khi được đặt sau một mặt nạ hấp thụ, thiết bị cảm ứng CZT cũng hoàn toàn có thể được sử dụng để xác lập hướng của những tia gamma. [ 119 ]
Các ứng dụng công nghiệp khác[sửa|sửa mã nguồn]
 Kẽm oxide được dùng làm chất tạo màu trắng trong sơnGần 1/4 tổng sản lượng kẽm của Hoa Kỳ ( 2009 ) được dùng ở dạng hợp chất kẽm ; [ 98 ] có nhiều loại được dùng ở quy mô công nghiệp. Kẽm oxide được sử dụng thoáng đãng để làm chất tạo màu trắng trong sơn, và làm chất xúc tác trong công nghiệp chế biến cao su đặc. Nó cũng được dùng làm chất phân tán nhiệt cho cao su đặc và phản ứng để bảo vệ những polyme của cao su đặc trước những tia tử ngoại ( cách bảo vệ chống tia tử ngoại tương tự như cũng được cho vào nhựa chứa oxide kẽm ). [ 16 ] Các đặc thù bán dẫn của kẽm oxide hữu dụng trong những varistor và mẫu sản phẩm máy photocopy. [ 120 ] Vòng tuần hoàn kẽm-kẽm oxide là một quá trình gồm 3 bước hóa nhiệt trong đó dùng kẽm và kẽm oxide để sản xuất hydro. [ 121 ]
Kẽm oxide được dùng làm chất tạo màu trắng trong sơnGần 1/4 tổng sản lượng kẽm của Hoa Kỳ ( 2009 ) được dùng ở dạng hợp chất kẽm ; [ 98 ] có nhiều loại được dùng ở quy mô công nghiệp. Kẽm oxide được sử dụng thoáng đãng để làm chất tạo màu trắng trong sơn, và làm chất xúc tác trong công nghiệp chế biến cao su đặc. Nó cũng được dùng làm chất phân tán nhiệt cho cao su đặc và phản ứng để bảo vệ những polyme của cao su đặc trước những tia tử ngoại ( cách bảo vệ chống tia tử ngoại tương tự như cũng được cho vào nhựa chứa oxide kẽm ). [ 16 ] Các đặc thù bán dẫn của kẽm oxide hữu dụng trong những varistor và mẫu sản phẩm máy photocopy. [ 120 ] Vòng tuần hoàn kẽm-kẽm oxide là một quá trình gồm 3 bước hóa nhiệt trong đó dùng kẽm và kẽm oxide để sản xuất hydro. [ 121 ]
Kẽm cloura thường được cho vào gỗ để làm chất bắt cháy[122] và có thể được sử dụng để bảo quản gỗ.[123] Nó cũng được dùng để tạo các hóa chất khác.[122] Kẽm methyl (Zn(CH3)
2) được dùng trong nhiều phản ứng tổng hợp hữu cơ.[124] Kẽm sulfide (ZnS) được dùng làm chất tạo màu phát quang như trên các đồng hồ đeo tay, màn hình ti vi và tia X, và sơn phát quang.[125] Các tinh thể kẽm được dùng trong các tia laser hoạt động trong dãi quang phổ hồng ngoại giữa.[126] Kẽm sulfat là một chất hóa học trong nhuộm và tạo màu.[122] Kẽm pyrithion được dùng trong sơn chống gỉ.[127]
Bột kẽm nhiều lúc được dùng làm chất tạo lực đẩy trong những quy mô tên lửa. [ 128 ] Khi một hỗn hợp nén gồm 70 % bột kẽm và 30 % bột lưu huỳnh bị đốt cháy sẽ tạo ra một phản ứng hóa học mãnh liệt. [ 128 ] Phản ứng này tạo ra kẽm sulfide cùng một lượng lớn khí nóng, nhiệt và ánh sáng. [ 128 ] Kim loại kẽm dạng tấm được dùng để chế ra những thanh kẽm. [ 129 ]
64
Zn, là đồng vị phổ biến nhất của kẽm, rất dễ bị kích hoạt neutron, được chuyển hóa thành 65
Zn phóng xạ rất cao, hạt nhân mới này có chu kỳ bán rã 244 ngày và sinh ra các tia phóng xạ gamma cường độ cao. Do vậy, kẽm oxide được dùng trong các lò phản ứng hạt nhân để làm chất chống ăn mòn cạn kiệt của 64
Zn trước khi sử dụng. Vì lý do tương tự, kẽm đã được đề xuất ở dạng vật liệu muối dùng trong các vũ khí hạt nhân (coban là một ví dụ khác, là một loại vật liệu muối phổ biến hơn).[130] Một lớp áo kẽm 64
Zn được làm giàu đồng vị có thể được chiếu xạ mởi một dòng neutron cường độ năng lượng cao từ việc kích nổ vũ khí nhiệt hạt nhân, tạo thành một lượng lớn đồng vị 65
Zn làm tăng đáng kể bụi phóng xạ của vũ khí hạt nhân.[130] Vũ khí như thế này không biết là đã có chế tạo, thử nghiệm hay sử dụng chưa.[130] 65
Zn cũng được dùng làm đồng vị vết trong nghiên cứu làm thế nào mà các hợp kim chứa kẽm ăn mòn, hoặc con đường và vai trò của kẽm trong sinh vật.[131]
Các phức kẽm dithiocarbamat được dùng làm thuốc diệt nấm trong nông nghiệp ; chúng gồm Zineb, Metiram, Propineb và Ziram. [ 132 ] Kẽm naphthenat được dùng là chất dữ gìn và bảo vệ gỗ. [ 133 ] Kẽm ở dạng ZDDP cũng được dùng làm chất phụ gia chống ăn mòn trong những bộ phận sắt kẽm kim loại của những động cơ chạy dầu. [ 134 ]
Bổ sung trong khẩu phần ăn[sửa|sửa mã nguồn]
 Viên kẽm GNC 50 mg ( AUKẽm có trong hầu hết những khẩu phần ăn cung cấp dưỡng chất và vitamin hàng ngày. [ 135 ] Các mẫu sản phẩm chế biến gồm kẽm oxide, kẽm acetat, và kẽm gluconat. [ 135 ] Nó được tin là có đặc thù chống oxy hóa, chúng hoàn toàn có thể chống lại sự ngày càng tăng vận tốc lão hóa của da và cơ trong khung hình ; những nghiên cứu và điều tra chỉ ra sự độc lạ về những hiệu suất cao của nó. [ 136 ] Kẽm cũng giúp làm tăng cường sự hồi sinh vết thương. [ 136 ] Nó cũng có những tính năng có lợi cho hệ miễn dịch của khung hình. Do vậy, sự thiếu vắng kẽm hoàn toàn có thể tác động ảnh hưởng đến hầu hết những phần của hệ miễn dịch ở con người. [ 137 ] Hiệu quả của những hợp chất kẽm khi sử dụng để làm giảm thời hạn hoặc mức độ nghiên trọng của triệu chứng cảm vẫn còn là yếu tố gây tranh cãi. [ 138 ] Một cuộc nhìn nhận một cách có mạng lưới hệ thống năm 2011 Kết luận rằng việc bổ trợ kẽm sẽ làm giảm nhẹ thời hạn và độ nghiêm trọng của bệnh cảm. [ 139 ]Kẽm đóng vai trò là một công cụ đơn thuần, rẻ tiền và quan trọng trong điều trị những cơn tiêu chảy ở trẻ nhỏ ở những nước đang tăng trưởng. Khi tiêu chảy kẽm trong khung hình giảm, nhưng những nghiên cứu và điều tra gần đây chỉ ra rằng kẽm bổ trợ trong vòng 10 đến 14 điều trị hoàn toàn có thể giảm thời hạn và độ nghiêm trọng của những côn tiêu chảy và cũng hoàn toàn có thể chống lại những cơn tiêu chảy trong vòng 3 tháng sau đó. [ 140 ]
Viên kẽm GNC 50 mg ( AUKẽm có trong hầu hết những khẩu phần ăn cung cấp dưỡng chất và vitamin hàng ngày. [ 135 ] Các mẫu sản phẩm chế biến gồm kẽm oxide, kẽm acetat, và kẽm gluconat. [ 135 ] Nó được tin là có đặc thù chống oxy hóa, chúng hoàn toàn có thể chống lại sự ngày càng tăng vận tốc lão hóa của da và cơ trong khung hình ; những nghiên cứu và điều tra chỉ ra sự độc lạ về những hiệu suất cao của nó. [ 136 ] Kẽm cũng giúp làm tăng cường sự hồi sinh vết thương. [ 136 ] Nó cũng có những tính năng có lợi cho hệ miễn dịch của khung hình. Do vậy, sự thiếu vắng kẽm hoàn toàn có thể tác động ảnh hưởng đến hầu hết những phần của hệ miễn dịch ở con người. [ 137 ] Hiệu quả của những hợp chất kẽm khi sử dụng để làm giảm thời hạn hoặc mức độ nghiên trọng của triệu chứng cảm vẫn còn là yếu tố gây tranh cãi. [ 138 ] Một cuộc nhìn nhận một cách có mạng lưới hệ thống năm 2011 Kết luận rằng việc bổ trợ kẽm sẽ làm giảm nhẹ thời hạn và độ nghiêm trọng của bệnh cảm. [ 139 ]Kẽm đóng vai trò là một công cụ đơn thuần, rẻ tiền và quan trọng trong điều trị những cơn tiêu chảy ở trẻ nhỏ ở những nước đang tăng trưởng. Khi tiêu chảy kẽm trong khung hình giảm, nhưng những nghiên cứu và điều tra gần đây chỉ ra rằng kẽm bổ trợ trong vòng 10 đến 14 điều trị hoàn toàn có thể giảm thời hạn và độ nghiêm trọng của những côn tiêu chảy và cũng hoàn toàn có thể chống lại những cơn tiêu chảy trong vòng 3 tháng sau đó. [ 140 ]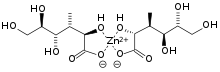 Kẽm gluconat là một hợp chất được sử dụng để cung cấp kẽm trong các bữa ăn.Nghiên cứu bệnh về mắt tương quan đến tuổi tác xác lập rằng kẽm góp một phần trong việc điều trị hiệu suất cao bệnh thoái hóa điểm vàng tương quan đến tuổi. [ 141 ] Bổ sung kẽm là một cách điều trị hiệu suất cao bệnh rối loại di truyền tương quan đến hấp thu kẽm mà trước đây gây tử trận ở những trẻ mới mắc bệnh này bẩm sinh. [ 53 ]Viêm dạ dày giảm mạnh khi uống kẽm, và hiệu ứng này hoàn toàn có thể là do đặc thù kháng khuẩn mạnh của những ion kẽm trong đường tiêu hóa, hoặc so với sự hấp thụ kẽm và tái giải phóng từ những tế bào miễn dịch ( toàn bộ hạch bạch cầu đều tiết ra kẽm ), hoặc cả hai. [ 142 ] [ 143 ] [ note 3 ] Năm 2011, những nghiên cứu viên ở trường cao đẳng tư pháp hình sự John Jay thông tin rằng việc cung ứng kẽm trong khẩu phần ăn hoàn toàn có thể làm ẩn đi sự hiện hữu của ma túy trong nước tiểu. Các công bố tựa như cũng được đăng trên những forum về chủ đề đó. [ 144 ]Mặc dù chưa thử nghiệm trong điều trị ở người, tín hiệu của một khung hình đang tăng trưởng ám chỉ rằng kẽm hoàn toàn có thể ưu tiên hủy hoại tế bào ung thư tuyến tiền liệt. Do kẽm xuất hiện tự nhiên trong tuyến tiền liệt và vì tuyến này dễ xâm nhập với những phương pháp không xâm lấn một cách tương đối, tiềm năng của nó như thể một tác nhân hóa trị loại bệnh ung thư này bộc lộ nhiều hứa hẹn. [ 145 ] Tuy nhiên, những nghiên cứu và điều tra khác đã minh họa rằng sử dụng kẽm bổ trợ lâu dài hơn với liều lượng vượt mức được cho phép hoàn toàn có thể thực tiễn làm ngày càng tăng thời cơ tăng trưởng ung thư tuyến tiền liệt, cũng hoàn toàn có thể là do sự tích tụ tự nhiên của sắt kẽm kim loại nặng này trong tuyến tiền liệt. [ 146 ]
Kẽm gluconat là một hợp chất được sử dụng để cung cấp kẽm trong các bữa ăn.Nghiên cứu bệnh về mắt tương quan đến tuổi tác xác lập rằng kẽm góp một phần trong việc điều trị hiệu suất cao bệnh thoái hóa điểm vàng tương quan đến tuổi. [ 141 ] Bổ sung kẽm là một cách điều trị hiệu suất cao bệnh rối loại di truyền tương quan đến hấp thu kẽm mà trước đây gây tử trận ở những trẻ mới mắc bệnh này bẩm sinh. [ 53 ]Viêm dạ dày giảm mạnh khi uống kẽm, và hiệu ứng này hoàn toàn có thể là do đặc thù kháng khuẩn mạnh của những ion kẽm trong đường tiêu hóa, hoặc so với sự hấp thụ kẽm và tái giải phóng từ những tế bào miễn dịch ( toàn bộ hạch bạch cầu đều tiết ra kẽm ), hoặc cả hai. [ 142 ] [ 143 ] [ note 3 ] Năm 2011, những nghiên cứu viên ở trường cao đẳng tư pháp hình sự John Jay thông tin rằng việc cung ứng kẽm trong khẩu phần ăn hoàn toàn có thể làm ẩn đi sự hiện hữu của ma túy trong nước tiểu. Các công bố tựa như cũng được đăng trên những forum về chủ đề đó. [ 144 ]Mặc dù chưa thử nghiệm trong điều trị ở người, tín hiệu của một khung hình đang tăng trưởng ám chỉ rằng kẽm hoàn toàn có thể ưu tiên hủy hoại tế bào ung thư tuyến tiền liệt. Do kẽm xuất hiện tự nhiên trong tuyến tiền liệt và vì tuyến này dễ xâm nhập với những phương pháp không xâm lấn một cách tương đối, tiềm năng của nó như thể một tác nhân hóa trị loại bệnh ung thư này bộc lộ nhiều hứa hẹn. [ 145 ] Tuy nhiên, những nghiên cứu và điều tra khác đã minh họa rằng sử dụng kẽm bổ trợ lâu dài hơn với liều lượng vượt mức được cho phép hoàn toàn có thể thực tiễn làm ngày càng tăng thời cơ tăng trưởng ung thư tuyến tiền liệt, cũng hoàn toàn có thể là do sự tích tụ tự nhiên của sắt kẽm kim loại nặng này trong tuyến tiền liệt. [ 146 ]
Viên ngậm kẽm và trị cảm thông thường[sửa|sửa mã nguồn]
Những hiệu quả tích cực nhất trong việc sử dụng viên ngậm kẽm được phát hiện trong điều tra và nghiên cứu trên kẽm acetat, bộc lộ qua việc acetat không link với những ion kẽm. [ 147 ] [ 148 ] Các nghiên cứu và điều tra cho đến nay cũng chưa đưa ra Tóm lại nhưng đã chỉ ra rằng những viên kẽm làm giảm những triệu chứng kẽm trong khi hoàn toàn có thể gây ra công dụng phụ như buồn nôn. [ 149 ] Những quyền lợi của kẽm dùng trong điều trị cảm đã được diễn đạt là ” rất ít “. [ 150 ]Cơ chế sinh học của tính năng này chưa rõ, nhưng quyền lợi của những loại kẽm thoi có vẻ như bị gây nên bởi những hiệu ứng tại chỗ trong vùng hầu họng, vì điều trị kẽm qua đường mũi cũng rút ngắn thời hạn cảm. [ 151 ] [ 152 ]
Dùng làm thuốc ngoài da[sửa|sửa mã nguồn]
Kẽm dùng trong điều trị ngoài da thường được làm từ kẽm oxide. Các hợp chất này hoàn toàn có thể chống cháy nắng trong mùa hè và khô vì lạnh trong mùa đông. [ 53 ] Thoa một lớp mỏng dính trên vùng mặc tã của bé ( perineum ) mỗi lần thay tã lót hoàn toàn có thể bảo vệ khỏi hăm do tã. [ 53 ]Kẽm lactat được dùng trong kem đánh răng để chống chứng hôi miệng. [ 153 ] Kẽm pyrithion được sử dụng thoáng rộng trong dầu gội đầu do nó có tính năng chống gàu. [ 154 ] Các ion kẽm là chất chống vi sinh rất hiệu suất cao thậm chí còn ở nồng độ thấp. [ 155 ]
Hóa hữu cơ[sửa|sửa mã nguồn]
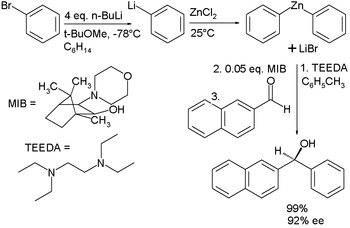 Thêm kẽm diphenyl vào một andehit
Thêm kẽm diphenyl vào một andehit
Có nhiều hợp chất kẽm hữu cơ quan trọng. Hóa học kẽm hữu cơ là một khoa học nghiên cứu về các hợp chất vô cơ của kẽm miêu tả đặc điểm vật lý, sự tổng hợp và các phản ứng của chúng.[156][157][158][159]
Trong số các ứng dụng quan trọng phải kế đến là phản ứng Frankland-Duppa theo đó một oxalat este(ROCOCOOR) phản ứng với alkyl halide R’X, kẽm và acid clohydrit để tạo ra este α-hydroxycarboxylic RR’COHCOOR,[160] phản ứng Reformatskii biến đổi α-halo-este và andehit thành β-hydroxy-este, phản ứng Simmons-Smith theo đó kẽm carbenoid (iodomethyl) iodide phản ứng với anken (hoặc ankin) và biến đổi chúng thành cyclopropan, phản ứng thêm vào của các hợp chất kẽm hữu cơ tạo thành các hợp chất carbonyl. Phản ứng Barbier (1899) là sự cân bằng kẽm của phản ứng Grignard magiê và tốt hơn là cả hai phản ứng. Sự có mặt của một lượng nước bất kỳ trong sự thành tạo magnesi hữu cơ halide sẽ không thành công, ngược lại phản ứng Barbier có thể thậm chí diễn ra trong môi trường nước. Mặt khác các kẽm hữu cơ ít ái nhân hơn Grignards, rất đắt và khó vận chuyển. Các hợp chất kẽm có hai gốc hữu cơ có trên thị trường là kẽm dimetyl, kẽm dietyl và kẽm diphenyl. Trong một nghiên cứu[161][note 4] hợp chất kẽm hữu cơ hoạt động được xem là rẽ hơn nhiều so với tiền chất brom hữu cơ:
Phản ứng tuy nhiên hợp Negishi cũng là một phản ứng quan trọng để tạo thành những link carbon-carbon mới giữa những nguyên tử carbon không no trong anken, aren và ankyn. Các chất xúc tác là niken và palladi. Một bước quan trọng trong chu vòng tuần hoàn xúc tác đó là kẽm halide trao đổi bằng cách thay thế sửa chữa gốc hữu cơ của nó với một halogen khác bằng sắt kẽm kim loại palladi ( niken ). Phản ứng tuy nhiên hợp Fukuyama là một kiểu phản ứng khác như phản ứng này có 3 gốc este tham gia phản ứng để tạo thành một xeton .Kẽm có nhiều ứng dụng làm chất xúc tác trong tổng hợp hữu cơ như tổng hợp bất đối xứng, là một giải pháp rẻ và dễ triển khai thay cho những chất phức sắt kẽm kim loại quý. Các tác dụng thu được bằng cách sử dụng chất điện phân kẽm chiral hoàn toàn có thể so sánh với giải pháp thu được palladi, rutheni, iridi và những sắt kẽm kim loại khác và do đó kẽm trở thành sắt kẽm kim loại được lựa chọn ngày càng nhiều cho mục tiêu này. [ 162 ]
Vai trò sinh học[sửa|sửa mã nguồn]
Kẽm là nguyên tố thiết yếu để duy trì sự sống của con người [ 163 ] cũng như những động vật hoang dã khác, [ 164 ] thực vật, [ 93 ] và vi sinh vật. [ 165 ] Kẽm được tìm thấy trong gần 100 loại enzym đặc biệt quan trọng [ 166 ] ( những nguồn khác [ 167 ] cho rằng tới 300 ), có vai trò là những ion cấu trúc trong yếu tố phiên mã và được tàng trữ và luân chuyển ở dạng thionein sắt kẽm kim loại. [ 168 ] Nó là ” sắt kẽm kim loại chuyển tiếp thông dụng thứ 2 trong sinh vật ” sau sắt và nó là sắt kẽm kim loại duy nhất xuất hiện trong toàn bộ những lớp enzym. [ 93 ]Trong những protein, những ion kẽm thường link với những chuỗi amino acid của acid aspartic, acid glutamic, cystein và histidin. [ 169 ] Việc miêu tả kim chỉ nan và thống kê giám sát của những link kẽm trong những protein này cũng như so với những sắt kẽm kim loại chuyển tiếp khác còn khó khăn vất vả. [ 169 ]Có từ 2-4 gam kẽm [ 170 ] phân bổ trong khắp khung hình con người. Hầu hết kẽm nằm trong não, cơ, xương, thận và gan, tuy nhiên nồng độ kẽm cao nhất tập trung chuyên sâu trong tuyến tiền liệt và những bộ phận của mắt. [ 171 ] Tinh dịch đặc biệt quan trọng rất giàu kẽm, vì đây là yếu tố quan trọng trong tính năng của tuyến tiền liệt và giúp tăng trưởng cơ quan sinh dục. [ 172 ]
Kẽm đóng vai trò sinh học quan trọng đối với con người.[6] Nó tương tác với một loạt các phối tử hữu cơ,[6] và có vai trò quan trọng trong quá trình trao đổi chất của RNA và DNA, truyền tín hiệu và biểu hiện gen. Nó cũng quyết định quá trình chết rụng tế bào. Một nghiên cứu năm 2006 ước tính rằng khoảng 10% protein người (2.800) có thể phụ thuộc vào kẽm, thêm vào đó hàng trăm protein vận chuyển kẽm; một nghiên cứu tương tự về in silico trong loài thực vật Arabidopsis thaliana đã tìm thấy 2.367 protein liên quan đến kẽm.[93]
Trong não, kẽm được tàng trữ trong những synaptic vesicles đặc biệt quan trọng bởi những tế bào thần kinh glutamatergic [ 173 ] và hoàn toàn có thể ” kiểm soát và điều chỉnh năng lực kích thích não “. [ 6 ] Nó có vai trò quan trọng trong synaptic plasticity và cũng như trong việc học. [ 174 ] Tuy nhiên, nó được gọi là ” ngựa đen của não ” ( ” the brain’s dark horse ” ) [ 173 ] vì nó cũng hoàn toàn có thể là một chất độc thần kinh, homeostasis kẽm đóng vai trò quan trọng trong tính năng thông thường của não và hệ thần kinh TW. [ 173 ]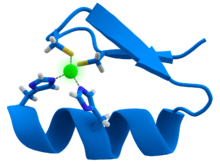 Kẽm giúp đọc mã DNA .
Kẽm giúp đọc mã DNA .
Kẽm là một acid Lewis, là một chất xúc tác có ích trong quá trình hydroxyl hóa và các phản ứng enzym khác.[166] Kim loại kẽm cũng là một chất có phối hợp hình học linh động, điều này cho phép các protein sử dụng nó để thay đổi cấu trúc protein một cách nhanh chóng để thực hiện các phản ứng sinh học.[175] Hai ví dụ về các enzym chứa kẽm là carbonic anhydrase và carboxypeptidase, đây là các enzym cần thiết trong các quá trình của chuyển hóa cacbon dioxide (CO
2) và tiêu hóa protein theo thứ tự.[176]
Trong máu của động vật có xương sống, carbonic anhydrase chuyển hóa CO
2 thành bicacbonat và cùng enzym đó chuyển bicacbonat trở lại thành CO
2 khi thở qua phổi.[177] Nếu không có enzym này, sự biến đổi này có thể diễn ra chậm hơn khoảng 1 triệu lần[178] đối với máu bình thường có pH là 7 hoặc không thì pH phải 10 hoặc lớn hơn.[179] Anhydrase không liên quan β-carbonic là cần thiết cho sự hình thành lá ở thực vật, sự tổng hợp indole acid acetic (auxin) và hô hấp kị khí (lên men rượu).[180]
Carboxypeptidase tách những link peptit trong quy trình tiêu hóa protein. Liên kết cộng hóa trị phối hợp được tạo ra giữa những peptit đầu cuối và nhóm C = O gắn với kẽm, làm cho cacbon tích điện dương. Yếu tố này giúp tạo ra một hốc kị nước trên enzym gần kẽm, làm hút phần không phân cực của protein bị tiêu hóa. [ 176 ]
Các protein khác[sửa|sửa mã nguồn]
Kẽm có vai trò cấu trúc toàn bộ trong cụm, xoắn và ngón tay kẽm.[181] Các kẽm finger tạo thành các bộ phận của một số yếu tố phiên mã (transcription factor), chúng là các protein nhận dạng trình tự DNA trong quá trình phiên mã và sao chép DNA. Mỗi ion Zn2+
thứ 9 hoặc 10 trong ngón tay kẽm giúp duy trình cấu trúc của các ngón tay bằng cách tạo liên kết với 4 amino acid trong nhân tố phiên mã.[178] Yếu tố phiên mã bao bọc xung quanh xoắn DNA và sử dụng các finger của nó để liên kết một cách chính xác với chuỗi DNA.
Trong huyết tương, kẽm bị ràng buộc và bị luân chuyển bởi albumin ( 60 %, ái lực thấp ) và transferrin ( 10 % ). [ 170 ] Vì transferrin cũng luân chuyển sắt, khi lượng sắt tăng quá cao làm giảm năng lực hấp thụ kẽm và ngược lại. Phản ứng tương tự như cũng xảy ra so với đồng. [ 182 ] Hàm lượng kẽm trong huyết tương ở mức tương đối không thay đổi bất kể lượng kẽm tiêu thụ vào là bao nhiêu. [ 183 ] Các tế bào trong tuyến nước bọt, tuyến tiền liệt, hệ miễn dịch và ruột sử dụng tín hiệu kẽm như là cách để liên lạc với những tế bào khác. [ 184 ]Kẽm hoàn toàn có thể được giữ trong thionein sắt kẽm kim loại trong vi sinh vật hoặc trong ruột hoặc gan động vật hoang dã. [ 185 ] Thionein sắt kẽm kim loại trong những tế bào ruột hoàn toàn có thể kiểm soát và điều chỉnh sự hấp thụ kẽm khoảng chừng 15-40 %. [ 186 ] Tuy nhiên thiếu hoặc thừa kẽm hoàn toàn có thể gây hại ; đặc biệt quan trọng thừa kẽm làm giảm hấp thụ đồng do thionein sắt kẽm kim loại hấp thụ cả hai sắt kẽm kim loại như đã nghiên cứu và phân tích ở trên. [ 187 ] Dải tìm hiểu thêm so với những thí nghiệm máu biểu lộ kẽm có màu tím nằm chính giữa ở trên
Dải tìm hiểu thêm so với những thí nghiệm máu biểu lộ kẽm có màu tím nằm chính giữa ở trên
Chế độ nhà hàng[sửa|sửa mã nguồn]
 Những thức ăn chứa nhiều Kẽm
Những thức ăn chứa nhiều Kẽm
Ở Mỹ, chế độ ăn chỉ định (Recommended Dietary Allowance – RDA) là 8 mg/ngày đối với nữ giới và 11 mg/ngày đối với nam giới.[188] Chế độ ăn trung bình ở Mỹ năm 2000 là 9 mg/ngày đối với nữ giới và 14 mg/ngày đối với nam giới.[189] Hàu, tôm hùm[190] và các loại thịt đỏ, đặc biệt là thịt bò, thịt cừu và gan bò là các thực phẩm có hàm lượng kẽm cao.[172]
Hàm lượng kẽm trong thực vật biến hóa tùy theo hàm lượng nguyên tố này trong đất. Khi đất có đủ lượng kẽm, thực phẩm từ thực vật chứa kẽm nhiều như lúa mì, và những loại hạt khác ( mè, anh túc, cỏ linh lăng, cần tây, mù tạc ). [ 191 ] Các nguồn thức ăn tự nhiên giàu kẽm khác gồm có : những loại quả có nhân, ngũ cốc nguyên vẹn, hạt bí hay hạt hướng dương. [ 192 ]Các nguồn khác trong thực phẩm tăng cường và chính sách siêu thị nhà hàng bổ trợ cũng có nhiều dạng. Một báo cáo giải trình năm 1998 Kết luận rằng kẽm oxide, là một trong những chất bổ sung thông dụng nhất ở Mỹ, và kẽm cacbonat là loại gần như không hòa tan và kém được hấp thu trong khung hình. [ 193 ] Bài báo này trích dẫn những điều tra và nghiên cứu phát hiện rằng những hàm lượng kẽm plasma thấp sau khi ăn kẽm oxide và kẽm cacbonat so với những trường hợp sau khi tiêu thụ kẽm acetat và kẽm sulfat. [ 193 ] Tuy nhiên, bổ trợ kẽm vượt mức gây hại là một yếu tố trong số những người tương đối giàu, và hoàn toàn có thể không nên vượt quá 20 mg / ngày ở người khỏe mạnh, [ 194 ] mặc dầu Hội đồng Nghiên cứu quốc gia Hoa Kỳ đưa ra mức trần là 40 mg / ngày. [ 195 ]Tuy nhiên, trong việc tăng cường kẽm, một nhìn nhận năm 2003 cho rằng kẽm oxide trong ngũ cốc rẽ, không thay đổi và dễ hấp thu hơn những loại đắt tiền hơn. [ 196 ] Một điều tra và nghiên cứu năm 2005 phát hiện rằng nhiều hợp chất kẽm gồm có cả dạng oxide và sulfat, không cho thấy sự độc lạ đáng kể về thống kê trong việc hấp thụ khi thêm vào bánh ngô. [ 197 ] Một điều tra và nghiên cứu năm 1987 cho thấy rằng kẽm picolinat được hấp thụ tốt hơn so với kẽm gluconat hay kẽm citrat. [ 198 ] Tuy nhiên, một nghiên cứu và điều tra công bố năm 2008 khẳng định chắc chắn rằng kẽm glycinat được hấp thụ tốt nhất trong bốn loại bổ trợ kẽm trên thị trường. [ 199 ]
Thiếu kẽm thường là do dinh dưỡng thiếu kẽm, nhưng cũng hoàn toàn có thể tương quan đến sự hấp thu kẽm kém, acrodermatitis enteropathica, bệnh gan mãn tính, bệnh thận mãn tính, bệnh hồng cầu hình liềm, tiểu đường, bệnh ác tính và những bệnh mãn tính khác. [ 7 ] Các triệu chứng thiếu kẽm nhẹ rất phong phú. [ 189 ] Biểu hiện lâm sàng gồm có chậm tăng trưởng, tiêu chảy, bất lực và chậm phát dục, rụng tóc, tổn thương da và mắt, giảm cảm xúc ngon miệng, đổi khác nhận thức, làm suy giảm năng lực bảo vệ của khung hình, khiếm khuyết trong việc sử dụng carbohydrat, và sinh quái thai. [ 183 ] Thiếu kẽm nhẹ làm giảm miễn dịch, [ 200 ] mặc dầu dư thừa kẽm cũng giảm miễn dịch. [ 170 ] Động vật có chính sách ăn thiếu kẽm thì cần lượng thức ăn tăng gấp đôi để bù lại lượng kẽm so với những động vật hoang dã được phân phối đủ kẽm. [ 125 ]Các nhóm có rủi ro tiềm ẩn thiếu kẽm gồm có người già, và những người suy thận. Kẽm chelat phytat được tìm thấy trong hạt và ngũ cốc cám hoàn toàn có thể góp thêm phần vào việc kém hấp thu kẽm. [ 7 ]Mặc dù có những lo lắng, [ 201 ] nhưng những người ăn chay phương Tây không được phát hiện là thiếu vắng kẽm nhiều so với những người ăn thịt. [ 202 ] Các nguồn thực vật phân phối kẽm như đậu khô, rau biển, ngũ cốc tăng cường, thực phẩm từ đậu nành, đậu phụng, những loại hạt, đậu Hà Lan, mầm hạt. [ 201 ] Tuy nhiên, phytat trong nhiều loại hạt và chất xơ trong thực phẩm hoàn toàn có thể tác động ảnh hưởng đến việc hấp thụ kẽm và uống kẽm gần số lượng giới hạn biên có những hiệu ứng chưa được rõ. Có một vài dẫn chứng cho thấy rằng sử dụng lượng kẽm nhiều hơn so với tiêu chuẩn của US RDA ( 15 mg ) hàng ngày hoàn toàn có thể là thiết yếu cho những người có chính sách nhà hàng mà phytat cao, như 1 số ít người ăn chay. [ 201 ] Việc giám sát này phải được cân đối với thực tiễn rằng có một lượng rất ít những chỉ số sinh học kẽm rất đầy đủ, và là chỉ số được sử dụng thoáng rộng nhất, kẽm plasma, có độ nhạy và độ đặc hiệu kém. [ 203 ] Chẩn đoán thiếu kẽm là một thử thách vĩnh viễn. [ 6 ]Thiếu kẽm là trường hợp thiếu vi chất dinh dưỡng thông dụng nhất ở thực vật, đặc biệt quan trọng là trong đất có độ pH cao. Đất thiếu kẽm được canh tác trong những cánh đồng của phân nửa Thổ Nhĩ Kỳ và Ấn Độ, 1/3 ở Trung Quốc và hầu hết miền Tây Úc, và có những phản hồi đáng kể về việc bổ trợ phân kẽm đã được báo cáo giải trình ở những khu vực này. [ 93 ] Thực vật tăng trưởng trong những loại đất thiếu kẽm dễ bị mắc bệnh hơn. Kẽm về cơ bản được bổ trợ vào đất trải qua quy trình phong hóa từ những loại đá, nhưng con người đã đưa kẽm vào trong đất qua quy trình đốt nguyên vật liệu hóa thạch, chất thải mỏ, phân lân, đá vôi, phân, bùn thải và những hạt từ những mặt phẳng mạ kẽm. Kẽm dư thừa là chất độc so với cây, mặc dầu độ độc của kẽm ít phổ cập. [ 93 ]Gần 2 tỉ người ở những nước đang tăng trưởng bị thiếu kẽm. [ 7 ] Ở trẻ nhỏ, thiếu kẽm làm ngày càng tăng nhiễm trùng và tiêu chảy làm khoảng chừng 800.000 trẻm em thiệt mạng mỗi năm trên toàn thế giới. [ 6 ] WHO có chủ trương bổ trợ kẽm cho trẻ suy dinh dưỡng nặng và tiêu chảy. [ 204 ] Bổ sung kẽm giúp ngăn ngừa bệnh tật và giảm tử trận, đặc biệt quan trọng là trẻ nhỏ sinh thiếu cân hoặc chậm tăng trưởng. [ 204 ] Tuy nhiên, bổ trợ kẽm không nên được phân phối một cách riêng không liên quan gì đến nhau vì 1 số ít trường hợp thiếu kẽm ở những vương quốc đang tăng trưởng hoàn toàn có thể tương quan đến sự tương tác của kẽm với những vi chất dinh dưỡng khác. [ 205 ]
Phục hồi đất[sửa|sửa mã nguồn]
Ericoid Mycorrhizal Fungi Calluna, Erica và Vaccinium hoàn toàn có thể tăng trưởng trên đất giàu kẽm. [ 206 ]
Thiếu kẽm trong nông nghiệp là sự thiếu vắng vi chất dinh dưỡng phổ cập nhất những loài cây xanh ; đặc biệt quan trọng thông dụng trong đất có pH cao. [ 207 ] Thiếu kẽm trong đất trồng chiếm nửa diện tích quy hoạnh của Thổ Nhĩ Kỳ và Ấn Độ, 1/3 ở Trung Quốc, và hầu hết ở Tây Úc, và phản ứng hầu hết so với phân kẽm đã được báo cáo giải trình ở những khu vực này. [ 93 ] Thực vật tăng trưởng trên đất thiếu kẽm dễ bị sâu bệnh. Kẽm được bổ trợ vào đất hầu hết từ quy trình phong hóa đá, nhưng con người đã thêm kẽm qua việc đốt những nguyên vật liệu hóa thạch, chất thải mỏ, phân phosphat, thuốc trừ sâu ( kẽm photphit ), đá vôi, phân, bùn thải, và những hạt ở dạng xi mạ. Thừa kẽm cũng là chất độc so với cây cối, mặc dầu ngộ độc kẽm ít phổ cập hơn. [ 93 ]
Mặc dù kẽm là vi chất cần thiết cho sức khỏe, tuy nhiên nếu hàm lượng kẽm vượt quá mức cần thiết sẽ có hại cho sức khỏe. Hấp thụ quá nhiều kẽm làm ngăn chặn sự hấp thu đồng và sắt.[187] Ion kẽm tự do trong dung dịch là chất có độc tính cao đối với thực vật, động vật không xương sống, và thậm chí là cả động vật có xương sống.[208] Mô hình hoạt động của ion tự do đã được công bố trong một số ấn phẩm, cho thấy rằng chỉ một lượng mỏ mol ion kẽm tự do cũng giết đi một số sinh vật. Một thí nghiệm gần đây cho thấy 6 micromol giết 93% Daphnia trong nước.[209]
Ion kẽm tự do là một acid Lewis mạnh đến mức hoàn toàn có thể ăn mòn. Acid dịch vị chứa acid clohydric, mà hàm lượng kẽm sắt kẽm kim loại trong đó dễ hòa tan trong đó gây ăn mòn kẽm chloride. Nuốt đồng xu 1 cent của Mỹ năm 1982 ( 97,5 % kẽm ) hoàn toàn có thể làm hỏng niêm mạc dạ dày do năng lực hòa tan cao của những ion kẽm trong dịch vị. [ 210 ]Có vật chứng về sự thiếu vắng đồng khi uống ở mức thấp một lượng kẽm 100 – 300 mg / ngày ; một thử nghiệm gần đây cho thấy số người nhập viện cao hơn tương quan đến những biến chứng tiết niệu so với ” thuốc trấn an ” trong số đàn ông lớn tuổi uống 80 mg / day. [ 211 ] USDA RDA khuyến khích uống 11 và 8 mg Zn / ngày theo thứ tự so với đàn ông và phụ nữ. [ 188 ] Thậm chí ở những mức thấp hơn, gần với tiêu chuẩn RDA, hoàn toàn có thể can thiệp với việc uống đồng và sắt, chống lại tác động ảnh hưởng của cholesterol. [ 187 ] Hàm lượng kẽm vượt quá 500 ppm trong đất gây rối cho năng lực hấp thụ những sắt kẽm kim loại thiết yếu khác của thực vật, như sắt và mangan. [ 94 ] Có những trường hợp gọi là sự run kẽm hay ớn lạnh kẽm sinh ra do hít phải những dạng bột oxide kẽm nguyên chất phát sinh trong quy trình mạ vật tư. [ 125 ] Kẽm là thành phần bổ biến của hàm răng giả, nó hoàn toàn có thể chứa 17 đến 38 mg kẽm / gram. Đã có những kiện cáo do mất tính năng, và thậm chí tử vong do sử dụng nhiều mẫu sản phẩm này. [ 212 ]Cơ quan quản trị thuốc và thực phẩm Hoa Kỳ ( FDA ) đã khuyến nghị rằng kẽm hủy hoại những thụ thể thần kinh trong mũi gây ra chứng mất khứu giác. Các báo cáo giải trình về chứng mất khứu giác cũng được quan sát trong thập niên 1930 khi những công tác làm việc chuẩn bị sẵn sàng kẽm để sử dụng trong một nỗ lực không thành công xuất sắc để ngăn ngừa sự lây nhiễm bệnh bại liệt. [ 213 ] Ngày 16 tháng 6 năm 2009, FDA thông tin rằng những người sử dụng kẽm nên dừng sử dụng những loại sản phẩm trị cúm có gốc kẽm và nhu yếu vô hiệu những mẫu sản phẩm đó trong những shop. FDA nói rằng việc không cảm nhận được mùi hoàn toàn có thể rình rập đe dọa đời sống vì dân cư không hề cảm nhận được sự rò rỉ của gas hoặc khói và không hề phân biệt rằng thực phẩm có bị hư trước khi họ ăn. [ 214 ] Nghiên cứu gần đây cho rằng kẽm pyrithion kháng khuẩn hoàn toàn có thể gây phản ứng sốc nhiệt tiềm ẩn cảm ứng hơn hoàn toàn có thể làm giảm tích toàn vẹn bộ gen với sự cảm ứng của PARP. [ 215 ]
Năm 1982, United States Mint mở màn đúc xu bằng đồng mạ kẽm nhưng đa phần là làm từ kẽm. Với những đồng kẽm mới, có năng lực gây ngộ độc kẽm, và hoàn toàn có thể gây tử trận. Một trường hợp ăn liên tục trong thời hạn dài 425 đồng xu kẽm ( hơn 1 kg kẽm ) gây tử trận do nhiễm vi trùng đường ruột và nhiễm trùng máu, trong khi một bệnh nhân khác ăn 12 gram kẽm chỉ cho thấy hôn mê và bất động. [ 216 ] Một số ca khác tương quan đến ngộ độc kẽm từ việc nuốt những đồng xu kẽm cũng được ghi nhận. [ 217 ] [ 218 ]
Các con chó đôi khi cũng nuốt các đồng xu và chỉ có cách dùng thuốc để loại chúng ra khỏi cơ thể. Hàm lượng kẽm trong một số đồng xu có thể gây ra ngộ độc kẽm, mà thường gây tử vong ở chó, vì nó gây ra các chứng thiếu máu (hemolytic anemia) nghiêm trọng, và cũng làm cho gan và thận bị tổn thương; các chứng nôn mửa và tiêu chảy.[219] Kẽm có độc tính cao đối với vẹt và sự ngộ độc có thể làm chết chúng.[220] Việc cho các con vẹt uống các loại nước ép trái cây trong các hộp mạ kẽm có thể làm cho chúng bị ngộ độc kẽm hàng loạt.[53]
Liên kết ngoài[sửa|sửa mã nguồn]
(tiếng Việt)
Source: https://mix166.vn
Category: Hỏi Đáp











