Quy tắc Klechkovsky – Wikipedia tiếng Việt
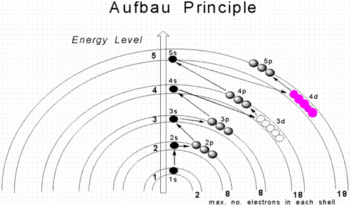 Các electron chiếm những lớp và phân lớp electron của một nguyên tử theo quy tắc Klechkovsky
Các electron chiếm những lớp và phân lớp electron của một nguyên tử theo quy tắc Klechkovsky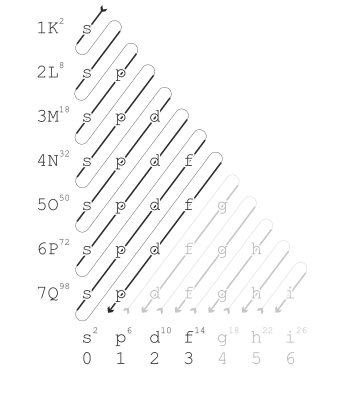 Thứ tự lấp đầy những orbital của vỏ nguyên tử bằng electron theo hướng của mũi tên
Thứ tự lấp đầy những orbital của vỏ nguyên tử bằng electron theo hướng của mũi tênQuy tắc Klechkovsky (còn viết là Klechkowski), có tên khác là quy tắc Madelung[1] hay nguyên lý vững bền (tiếng Anhː aufbau principle hay building-up principle) phát biểu rằng ở trạng thái cơ bản của nguyên tử hoặc ion, các electron lấp đầy orbital nguyên tử ở mức năng lượng từ thấp đến cao. Ví dụ, electron sẽ chiếm phân lớp 1s trước phân lớp 2s. Theo cách này, các electron của nguyên tử hoặc ion tạo thành cấu hình electron ổn định nhất có thể. Một ví dụ là cấu hình 1s2 2s2 2p6 3s2 3p3 cho nguyên tử phosphor, nghĩa là phân lớp 1s có 2 electron, phân lớp 2s có 2 electron… Quy tắc này được đề xuất bởi nhiều nhà hóa học, mà sau đó được gọi theo tên của Vsevolod Klechkovsky trong các tài liệu tiếng Việt.
Tính chất chiếm mức năng lượng của electron được xây dựng bởi các nguyên tắc khác của vật lý nguyên tử, như quy tắc Hund và nguyên lý loại trừ Pauli. Quy tắc Hund phát biểu rằng nếu có nhiều orbital cùng mức năng lượng, các electron sẽ chiếm các orbital khác nhau sao cho số electron độc thân là tối đa và các electron độc thân phải có spin cùng dấu. Khi các electron bắt cặp nhau, nguyên lý Pauli cho thấy các electron cùng orbital phải có spin khác nhau (+1/2 và −1/2).
Bạn đang đọc: Quy tắc Klechkovsky – Wikipedia tiếng Việt
Khi chúng ta đi từ nguyên tố này sang nguyên tố khác có số hiệu nguyên tử cao hơn liền kề, số proton và số electron của nguyên tử tăng thêm 1. Số electron tối đa trong bất kỳ lớp nào là 2n2, trong đó n là số lượng tử chính. Số electron tối đa trong một phân lớp (s, p, d hoặc f) bằng 2(2ℓ + 1) trong đó ℓ = 0, 1, 2, 3… Do đó, các phân lớp này có thể có tối đa là 2, 6, 10 và 14 electron tương ứng. Ở trạng thái cơ bản, cấu hình electron được thiết lập bằng cách đặt các electron vào các phân lớp có mức năng lượng thấp nhất cho đến khi tổng số electron bằng với số hiệu nguyên tử. Các orbital nguyên tử được điền theo thứ tự năng lượng tăng dần, sử dụng hai quy tắc chung để giúp dự đoán cấu hình electron:
- 1. Các electron được gán cho các orbital theo thứ tự giá trị tăng dần của (n + ℓ).
- 2. Đối với các phân lớp có cùng giá trị (n + ℓ), các electron được gán trước cho phân lớp có n nhỏ hơn.
Một phiên bản của quy tắc Klechkovsky là quy mô vỏ hạt nhân ( nuclear shell modell ) được sử dụng để Dự kiến thông số kỹ thuật của những proton và neutron trong hạt nhân nguyên tử. [ 2 ]
Mục lục bài viết
Diễn giải của quy tắc Klechkovsky[sửa|sửa mã nguồn]
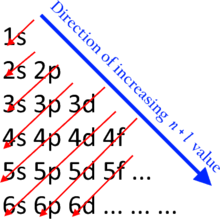 n + ℓ { \ displaystyle n + \ ell }
n + ℓ { \ displaystyle n + \ ell }
Trong các nguyên tử trung hòa ở trạng thái cơ bản, thứ tự gần đúng để điền electron vào các phân lớp được đưa ra theo quy tắc n + ℓ, còn được gọi là:
- Quy tắc Madelung (đề xuất bởi Erwin Madelung);
- Quy tắc Janet (đề xuất bởi Charles Janet);
- Quy tắc Klechkowsky (đề xuất bởi Vsevolod Klechkovsky);
- Nguyên lý vững bền;
- Quy tắc đường chéo.[3]
Trong đó n đại diện cho số lượng tử chính và ℓ là số lượng tử xung lượng; n là số nguyên thỏa mãn n ≥ 1 trong khi ℓ là số nguyên thỏa mãn 0 ≤ ℓ ≤ n – 1; các giá trị ℓ = 0, 1, 2, 3… tương ứng với các phân lớp s, p, d và f. Thứ tự phân lớp theo quy tắc này là:
1 s → 2 s → 2 p → 3 s → 3 p → 4 s → 3 d → 4 p → 5 s → 4 d → 5 p → 6 s → 4 f → 5 d → 6 p → 7 s → 5 f → 6 d → 7 p → 8 s → …
Ví dụ: titan (Z = 22) có cấu hình trạng thái cơ bản là 1s2 2s2 2p6 3s2 3p6 4s2 3d2.[4] Chú ý phân biệt thuật ngữː phân lớp ngoài cùng (có số lượng tử chính n lớn nhất trong cấu hình e nguyên tử) và phân lớp cuối cùng (chứa electron được điền cuối cùng có năng lượng cao nhất).
Một số tác giả viết những phân lớp luôn theo thứ tự tăng n, ví dụ điển hình như Ti ( Z = 22 ) 1 s2 2 s2 2 p6 3 s2 3 p6 3 d2 4 s2. [ 5 ] Đối với một nguyên tử trung hòa nhất định, hai cách viết thứ tự thông số kỹ thuật electron trên là tương tự vì sự chiếm chỗ orbital của electron chỉ có có ý nghĩa vật lý .
Các orbital có giá trị n + ℓ thấp hơn được điền trước các orbital có giá trị n + ℓ cao hơn. Trong trường hợp giá trị n + ℓ bằng nhau, orbital có giá trị n thấp hơn được điền trước. Tính chất này của các electron được xác nhận bằng thực nghiệm thông qua đặc tính phổ của từng nguyên tố.[6] Quy tắc trật tự năng lượng Klechkovsky chỉ áp dụng cho các nguyên tử trung hòa ở trạng thái cơ bản và không đúng hoàn toàn cho tất cả nguyên tử do sự tương tác của một số electron với nhau đóng vai trò ngày càng quan trọng khi số hiệu nguyên tử lớn hơn, nhưng chưa được tính đến trong các quy tắc này. Có mười nguyên tố trong số các kim loại chuyển tiếp và mười nguyên tố trong nhóm lanthan và actini mà quy tắc này dự đoán cấu hình electron khác với cấu hình thực nghiệm[7][8] là một số ngoại lệ.
Xem thêm: (PDF) Tổng quan về OLED
Một số sách giáo khoa hóa học vô cơ diễn đạt quy tắc Klechkovsky về cơ bản là quy tắc thực nghiệm gần đúng với một số ít cơ sở kim chỉ nan, [ 5 ] dựa trên quy mô Thomas – Fermi của nguyên tử như một hệ cơ học lượng tử nhiều electron. [ 9 ]
Ngoại lệ ở những sắt kẽm kim loại chuyển tiếp[sửa|sửa mã nguồn]
Phân lớp d ” mượn ” một electron ( trong trường hợp paladi là hai electron ) từ phân lớp s để đạt trạng thái bão hòa electron bền vững và kiên cố. Trạng thái bán bão hòa ( orbital đạt 50 % số electron tối đa ) cũng có sự không thay đổi năng lượng, dù kém hơn trạng thái bão hòa, là do mỗi orbital chỉ có một electron độc thân ( theo quy tắc Hund ), do đó lực đẩy electron-electron được giảm tối đa .
Nguyên tử
24 Cr
29 Cu
41 Nb
42 Mo
44 Ru
45 Rh
46 Pd
47 Ag
78 Pt
79 Au
Cấu hình electron lõi
[Ar]
[Ar]
[Kr]
[Kr]
[Kr]
[Kr]
[Kr]
[Kr]
[Xe]
[Xe]
Quy tắc Klechkovsky
3d4 4s2
3d9 4s2
4d3 5s2
4d4 5s2
4d6 5s2
4d7 5s2
4d8 5s2
4d9 5s2
4f14 5d8 6s2
4f14 5d9 6s2
Thực nghiệm
3d5 4s1
3d10 4s1
4d4 5s1
4d5 5s1
4d7 5s1
4d8 5s1
4d10
4d10 5s1
4f14 5d9 6s1
4f14 5d10 6s1
Ví dụ, ở đồng 29Cu, theo quy tắc Klechkovsky, orbital 4s (n + ℓ = 4 + 0 = 4) bị chiếm trước orbital 3d (n + ℓ = 3 + 2 = 5). Quy tắc dự đoán cấu hình electron của đồng là 1s2 2s2 2p6 3s2 3p6 3d9 4s2, viết tắt [Ar] 3d9 4s2 trong đó [Ar] biểu thị cấu hình electron của argon, khí hiếm trước chu kỳ đó. Tuy nhiên, cấu hình electron thực nghiệm của nguyên tử đồng là [Ar] 3d10 4s1. Bằng cách mượn 1 electron từ orbital 4s để bão hòa orbital 3d, cùng lúc thì orbital 4s cũng đạt trạng thái bán bão hòa. Lúc này đồng đạt trạng thái bền vững hơn, tức là có năng lượng thấp hơn. Giải thích tương tự như đồng, cấu hình electron ở 24Cr là [Ar] 3d5 4s1.
Ngoại lệ ở nhóm lanthan và actini[sửa|sửa mã nguồn]
Phân lớp d thường “mượn” một electron (trong trường hợp thorium là hai electron) từ phân lớp f. Ví dụ, trong urani 92U, theo quy tắc Klechkovsky, orbital 5f (n + ℓ = 5 + 3 = 8) bị chiếm trước orbital 6d (n + ℓ = 6 + 2 = 8). Quy tắc sau đó dự đoán cấu hình electron là [Rn] 5f 4 7s2 trong đó [Rn] biểu thị cấu hình của radon, khí hiếm trước chu kỳ đó. Tuy nhiên, cấu hình electron thực nghiệm của nguyên tử urani là [Rn] 5f 3 6d1 7s2.
Một ngoại lệ đặc biệt quan trọng là lawrenci 103L r, trong đó electron 6 d được Dự kiến bởi quy tắc Klechkovsky được sửa chữa thay thế bằng electron 7 p : quy tắc Dự kiến thông số kỹ thuật là [ Rn ] 5 f14 6 d1 7 s2, nhưng thông số kỹ thuật trong thực tiễn là [ Rn ] 5 f14 7 s2 7 p1 .
Nguyên tử
57 La
58 C
64 Gd
89 Ac
90 Th
91 Pa
92 U
93 Np
96 Cm
103 Lr
Cấu hình electron lõi
[Xe]
[Xe]
[Xe]
[Rn]
[Rn]
[Rn]
[Rn]
[Rn]
[Rn]
[Rn]
Quy tắc Klechkovsky
4f1 6s2
4f2 6s2
4f8 6s2
5f1 7s2
5f2 7s2
5f3 7s2
5f4 7s2
5f5 7s2
5f8 7s2
5f14 6d1 7s2
Thực nghiệm
5d1 6s2
4f1 5d1 6s2
4f7 5d1 6s2
6d1 7s2
6d2 7s2
5f2 6d1 7s2
5f3 6d1 7s2
5f4 6d1 7s2
5f7 6d1 7s2
5f14 7s2 7p1
Các thông số kỹ thuật electron ngoài nguyên tố 104R f vẫn chưa được xác nhận hoặc chứng tỏ rõ ràng và từ nguyên tố 120 về sau, quy tắc Klechkovsky dự kiến sẽ mất năng lực ứng dụng, nhường chỗ cho triết lý hóa học lượng tử tương đối tính ( relativistic quantum chemistry ) .
Quy tắc Klechkovsky trong thuyết lượng tử mới[sửa|sửa mã nguồn]
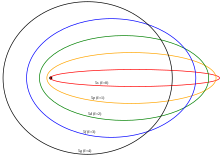 s và p) tiến gần đến hạt nhân hơnTrong thuyết lượng tử cũ, những quỹ đạo có momen động lượng thấp ( orbitalvà ) tiến gần đến hạt nhân hơn
s và p) tiến gần đến hạt nhân hơnTrong thuyết lượng tử cũ, những quỹ đạo có momen động lượng thấp ( orbitalvà ) tiến gần đến hạt nhân hơn
Trong các tài liệu tiếng Anh, quy tắc Klechkovsky được gọi là aufbau principle (hay building-up principle, nguyên lý vững bền), lấy tên gốc từ tiếng Đức Aufbauprinzip, thay vì đặt tên của một nhà khoa học. Nó được xây dựng bởi Niels Bohr[10] và Wolfgang Pauli vào đầu những năm 1920. Đây là một ứng dụng ban đầu của cơ học lượng tử cho các tính chất của electron và giải thích các tính chất hóa học theo thuật ngữ vật lý.
Trong thuyết lượng tử cũ (trước cơ học lượng tử), các electron được cho là chiếm các quỹ đạo hình elip cổ điển. Các quỹ đạo có momen động lượng cao nhất là “quỹ đạo tròn” chứa electron bên trong, nhưng các quỹ đạo có momen động lượng thấp (orbital s và p) có độ lệch tâm quỹ đạo cao, do đó chúng tiến gần đến hạt nhân hơn và chịu hiệu ứng lá chắn yếu hơn các electron bên ngoài vì các electron này ít chịu tác dụng của điện trường tạo ra bởi điện tích âm của các electron khác ở xa hạt nhân hơn. Ở trạng thái cơ bản của hydro chỉ có 1 electron nên không có sự khác biệt về năng lượng giữa các quỹ đạo có cùng số lượng tử chính n, nhưng điều này không đúng với các electron vỏ ngoài của các nguyên tử nguyên tố khác.
Quy tắc sắp xếp năng lượng n + ℓ
[sửa|sửa mã nguồn]
Một bảng tuần hoàn trong đó mỗi hàng tương ứng với một giá trị n + ℓ (các giá trị của n + ℓ tương ứng với các số lượng tử chính và xung lượng tương ứng) được Charles Janet đề xuất vào năm 1928. Vào năm 1930, ông đã đưa ra cơ sở lượng tử rõ ràng của bảng này, dựa trên kiến thức về trạng thái nguyên tử được xác định bằng phân tích phổ nguyên tử. Janet “điều chỉnh” một số giá trị n + ℓ thực tế của các nguyên tố, vì chúng không phù hợp với quy tắc sắp xếp năng lượng của ông và ông cho rằng sự sai khác số liệu xuất phát từ lỗi đo lường. Trong thực tế, các giá trị hiện nay là đúng và quy tắc sắp xếp năng lượng n + ℓ hóa ra là một xấp xỉ chứ không hoàn toàn chính xác.
Năm 1936, nhà vật lý người Đức Erwin Madelung đề xuất lý thuyết này như là một quy tắc thực nghiệm cho thứ tự lấp đầy các lớp vỏ nguyên tử. Do đó hầu hết các nguồn tiếng Anh gọi là quy tắc Madelung. Madelung có thể đã tìm ra quy tắc này sớm nhất vào năm 1926.[11] Năm 1962, nhà hóa học nông nghiệp người Nga V.M. Klechkovsky đề xuất giải thích lý thuyết đầu tiên về tầm quan trọng của tổng n + ℓ, dựa trên thống kê của mô hình Thomas – Fermi.[12] Do đó, nhiều nguồn tiếng Pháp, tiếng Nga và tiếng Việt đặt tên là quy tắc Klechkovsky.
Cần chú ý là sự ion hóa để tạo ion dương tương ứng với sự mất electron ở lớp hoặc phân lớp ngoài cùng (lớp hóa trị, lớp có trị số lớn nhất trong cấu hình electron), chứ không ngược lại với thứ tự lấp đầy orbital trong nguyên tử trung hòa. Còn sự ion hóa tạo ion âm tương ứng với sự nhận electron vào phân lớp cuối cùng của nguyên tử. Ví dụ đối với ion dương, trong hàng thứ tư của bảng tuần hoàn, quy tắc Klechkovsky chỉ ra rằng orbital 4s bị chiếm trước 3d. Do đó, các cấu hình trạng thái cơ bản của nguyên tử trung hòa Sc = [Ar]4s2 3d1. Tuy nhiên, nếu một nguyên tử Sc bị ion hóa thì cấu hình là Sc+ = [Ar] 4s1 3d1, Sc2+ = [Ar] 3d1, tức là electron ở phân lớp ngoài cùng là 4s bị mất trước phân lớp 3d, dù phân lớp 3d được điền electron sau 4s.
Ngoài việc có nhiều bằng chứng thực nghiệm củng cố cho quan điểm này, nó giúp cho lời lý giải về thứ tự ion hóa những electron trong sắt kẽm kim loại chuyển tiếp trở nên dễ hiểu hơn, cho rằng những electron 4 s luôn được ưu tiên ion hóa. [ 13 ]
Tài liệu khác[sửa|sửa mã nguồn]
Liên kết ngoài[sửa|sửa mã nguồn]
Source: https://mix166.vn
Category: Công Nghệ











